一
免疫PCR的定义
二
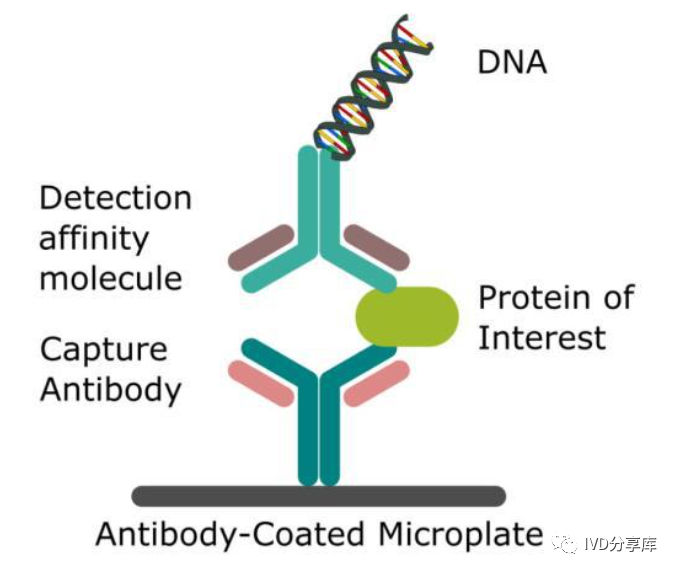
免疫PCR的基本原理

(3)连接分子。连接分子是连接特异抗体与DNA之间的分子。目前介绍的方法中均是通过生物素与亲和素系统使特异抗体与DNA连接,生物素和亲和素作为免疫PCR的连接分子在连接方式上有许多差异。Sano首次报道PCR时用的是重组葡萄球菌A蛋白-亲和素嵌合蛋白(SPA-亲和素)。其具有结合IgG和生物素的两个位点,因此可以将IgG与生物素化的DNA连接成复合物。由于重组的SPA-亲和素没有商品试剂,且SPA不但可以结合特异抗体的IgG,而且还可以与样品中吸附于固相的无关IgG结合,特别是检测的抗原就是某种IgG,因此,Ruzicka认为Sano的免疫PCR本底高且特异性差。
Ruzicke用商品化的亲和素系统试剂建立了一种免疫PCR,这种方法是先将亲和素与生物素化的DNA预结合成复合物,然后再与结合固相的特异性抗体结合,这种方法存在的问题是亲和素与生物素化的DNA分子预结合时二者的分子比例并不是等同的,一个亲和素分子可以结合4个分子生物素,因此,在预结合时生物素化的DNA分子不能过多,否则DNA分子上的生物素将亲和素完全饱和,亲和素再无结合生物素化抗体的能力;但在低饱和生物素化DNA时,亲和素结合的生物素化DNA存在许多种类的复合物,甚至还有游离的亲和素,只有部分结合生物素化DNA的亲和素才能起到连接分子的作用,因此,这样预结合的亲和素和生物素化DNA是一均质性很差的混合物。虽然预结合的复合物可以减少测试过程中的1次孵育和冲洗,但是这样的复合物作为连接分子必然导致敏感性低和误差大,并且每次制备的连接分子均有差异,从而导致重复性差。
Hong zhou等建立了一种免疫PCR方法,连接分子是链霉亲和素,在连接抗体和DNA时是以游离的方式加入,这样链霉亲和素先与生物素化抗体结合,冲洗后再加入生物素化的DNA。这个方法虽然多了1次孵育和冲洗过程,但具有较好的敏感性和重复性。
(4)生物素化DNA。免疫PCR中的DNA是一指示分子,用DNA聚合酶将结合于固相上的DNA特异放大,由此定量检测抗原。
免疫PCR的敏感性高于ELISA主要是应用了PCR强大的扩增能力。免疫PCR中的DNA分子可以选择任何DNA,但要保证DNA的纯度,且有较好的均质性,应尽可能不选用受检样品中可能存在的DNA。一般可选用质粒DNA或PCR产物等。
DNA的生物素化是用生物素标记的dATP或dUTP通过DNA聚合酶标记在DNA分子上,一般是1个分子DNA标记2个生物素,标记率可达100%。生物素化的DNA用量需预先选定,过多易出现非特异结合而引起本底过高,过低将导致敏感性低和出现不同浓度抗原得出同样结果的饱和现象。
(5)PCR扩增系统。免疫PCR的PCR扩增系统与一般PCR一样,主要包括引物、缓冲液和耐热DNA聚合酶。由于免疫PCR需用固相进行抗原抗体反应,同时又需要对固相结合的DNA进行扩增,因此,免疫PCR固相的选择应根据具体情况确定。用微量板作为周相必须有配套的PCR仪,以便可以用微量板直接扩增,否则需要用PCR反应管作为固相。
扩增后的PCR产物用琼脂糖凝胶电泳或聚丙烯酰胺凝胶电泳检测。根据产物的大小选择两种凝胶的浓度,电泳后凝胶经染色和拍照记录结果,再检测底片上PCR产物的光密度,并与标准品比较就可以得出待检抗原量。
三
免疫PCR的平台
免疫PCR最成功的平台是由Chimera Biotec GmbH(德国多特蒙德的生物技术公司)开发的IMPERACER平台。Chimera Biotec GmbH总部位于德国,其主要开发和销售超敏蛋白检测平台,具有三大生物分析检测平台:ELISA、IMPERACER和SIMOA,三种技术平台有其各自优缺点。其中IMPERACER就是采用的immuno-PCR技术。
IMPERACER将抗体偶联DNA作为检测试剂,通过real-time qPCR扩增来确定检测结果。和传统ELISA相比,具有以下几点优势:灵敏度高1000倍,检测范围达到五个数量级,基质背景低,需要样本量少。
来源: IVD分享库
声明:本平台注明来源的稿件均为转载,仅用于分享,不代表平台立场,如涉及版权等问题,请尽快联系我们,我们第一时间更正,谢谢!






