近几十年来,流式细胞仪改变了临床免疫诊断的格局[1]。这种复杂而强大的技术使用荧光基团标记的抗体对细胞进行各种生物标志物的荧光标记,然后对其进行分析,以单细胞的分辨率揭示生物标志物在细胞群中的分布模式[2]。
临床流式细胞仪的一个常见应用是免疫分型,识别免疫细胞以帮助诊断血液系统恶性肿瘤,特别是白血病和淋巴瘤[3-5]。它还被用于量化DNA细胞的含量[6],如儿童淋巴细胞白血病[7,8],这与患者的结果相关。此外,它对于分析治疗反应和检测治疗后残留的恶性细胞也很有用[9]。
免疫疾病治疗是流式细胞仪的另一个临床应用,它被用来识别HIV感染后的CD4+和CD8+T细胞亚群[10]或诊断原发性免疫缺陷[11]。它可以揭示异体骨髓或造血干细胞移植后某些免疫细胞亚群的存在[12,13]。临床流式细胞仪的一个新兴应用是使用荧光激活细胞分选(FACS)来收集满足某些表型标准的细胞后分析,分离干细胞用于移植或基于细胞的治疗[1]。
临床流式细胞仪的应用是通过验证的方案进行的,这些方案经过精心设计,考虑了最佳的荧光团组合,以尽量减少光谱重叠和足够的生物标志物来识别感兴趣的群体。此外,罕见的细胞群与荧光团亮度之间的平衡确保了感兴趣的群体能够被辨别出来。
流式细胞仪拥有几个优势,例如:
1) 单细胞分辨率能力,能够识别异质群体中的罕见细胞亚群,这可能对疾病诊断有重要影响[2];
2) 多重化,同时检测几种生物标志物[14];
3) 复杂但强大的仪器和软件处理包,性能稳定,数据分析方便;
4) 快速处理样品,更快告知治疗过程。
校准是关键
保持流式细胞仪处于良好的工作状态是很重要的。这意味着每天的仪器校准和标准化是必要的,以确保不同天收集的数据之间的一致性,并验证机器是否处于工作状态[2,15]。
这可以通过对参考珠进行校准检查来实现,参考珠是根据制造商的说明,在狭窄的公差范围内精心准备的,参考珠之间的差异很小,所有将被采用的颜色都是如此。这个过程测试仪器的灵敏度和线性度,并确保参考珠的平均荧光强度落在仪器的每个激光器的正确目标范围内。这个过程在大多数现代流式细胞仪中是自动进行的,仪器会产生所有测试参数的读数。
颜色补偿
与流式细胞仪中使用的抗体共轭的荧光团具有相对广泛的激发和发射曲线(图1)。这导致了荧光团之间的“串扰”,即旨在激发特定荧光团“A”的激光无意中导致“A”的一些信号进入“B”的通道[2]。颜色补偿是一个消除或尽量减少这种交叉干扰的过程,应该根据制造商的说明,用与每个荧光团共轭的参考珠进行检测,外加一个阴性对照。
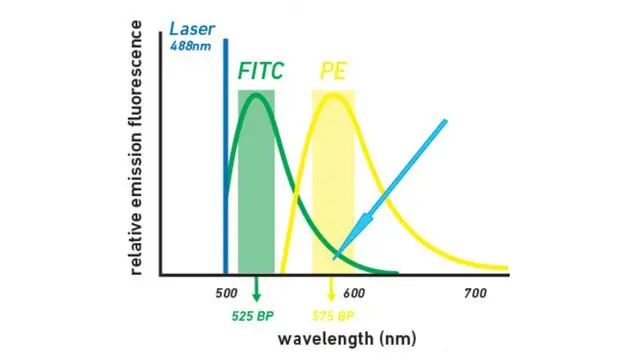
图1 | 异硫氰酸荧光素(FITC)和藻红蛋白(PE)发射光谱重叠的说明
用于激发FITC的488纳米激光导致FITC的发射溢出到PE的带通(BP)滤波器范围内(蓝色箭头所示),为PE通道的信号做出贡献。
质控考量
参考珠的光学参数与免疫细胞的光学参数不同。因此,一旦进行质量控制,最好使用上一次检测时的设置来运行特定的检测控制。在这个阶段,可以对光电倍增管电压(PMTV)的正向散射(FSC)和侧向散射(SSC)进行调整,使淋巴细胞达到标准。接下来,应使用以下方法进行控制:
1) 未染色的阴性细胞,其应低于先前确定的所有荧光通道中阳性细胞的阈值;
2) 检测中使用的每个荧光团的染色阳性对照,其应落在阈值以上的范围内;
3) 同种型抗体对照,其应落在阈值以下。
可以对每个荧光团颜色的PMTV进行调整,以细化阴性和阳性对照的位置。
样品的加入和处理
正确的样品处理需要将样品正确地记录到实验室的信息系统中,注意使用了哪种抗凝剂,因为它可能影响流动分析,并选择一种方法来裂解红细胞[2]。活-死染料对于区分活细胞和死细胞非常重要,从而将分析限制在活细胞上,并将死细胞排除在分析之外,因为死细胞可能会自动发光并导致背景噪音[15]。
如果只对细胞表面受体进行染色,可使用新鲜细胞,并采用膜完整性染料来区分活细胞和死细胞[2]。如果同时对细胞内蛋白质进行染色,则需要在固定和透化细胞内染色之前对表面受体进行染色。此外,用可固定的活力染料进行预处理对于活体和死体的鉴别是必要的,因为固定过程会使细胞渗透,从而排除了膜完整性染料的使用[16]。
一致性是关键
流式细胞仪是一种敏感的技术,要想在不同的实验中获得可重复的结果,必须限制变化,即使是较细微的实验参数,如细胞保存的温度、抗体染色程序和抗体结合的荧光团的曝光。
试剂验证
尽管试剂是按照严格的标准准备的,但批次与批次之间的差异仍然可能发生。此外,储存条件和运输及处理程序可能会影响敏感试剂,如抗体。为了确保试剂的行为符合预期,可以通过以下方式进行试剂验证:
1) 通过与参考材料的比较进行直接分析;
2) 对新旧试剂进行平行测试,例如在打开新试剂瓶/管时进行重叠测试;以及
3) 与对照组进行比较,例如使用商业QC细胞样本[2]。
新批次的抗体浓度可以通过对细胞(如淋巴细胞)的抗体滴定来验证,以确认检测中采用的抗体浓度。此外,良好的记录,如登记有效期和批号,也有助于减轻试剂因储存和时间而引起的变化。
数据分析
有很多方法可以对流式细胞仪收集的数据进行分析,也有多种格式可以显示数据。需要仔细考虑数据的完整性和特定分析方法的合理性,以确保它满足临床测试的需要。一旦确定了数据分析方法,重要的是对同一类型的临床流式检测,如前体B细胞淋巴细胞白血病的免疫分型,以相同的方式分析结果,以便获得一致的结果。
这包括:
1) 门控程序,这是一个决定分析首先考虑哪个荧光通道的过程[2];
2) 正确标记群体(例如,哪些细胞是前体B细胞);
3) 将群体注释为总事件的百分比或其门控群体的百分比;以及
4) 用于绘制结果的比例类型,例如,对数与双指数(HyperLog或“Logicle”)[2,15,17,18]。
感知模式
熟练掌握健康样本中的细胞群分布模式是很重要的,这样来自疾病患者的样本就能被辨别出来,脱颖而出。熟悉细胞的预期分布模式也有助于感知仪器在当天早些时候的校准和标准化后是否发生了问题,如碎片引起的流动池内的湍流,这可能会影响结果。
保护患者身份
由于患者的隐私,确保样本和数据的保密性和安全性是很重要的。密码保护和加密措施可以促进这一点。此外,数据的完整性和备份以防止数据丢失也是必不可少的保障措施。记录保存记忆 较新的流式细胞仪可以在校准后存储质控报告,使质控历史可以直接访问,以观察一段时间的趋势。另外,可以利用Levey-Jennings图来分析QC数据的演变[2]。如果质控值持续超出范围或持续高于或低于平均值,可能表明仪器出现了故障或漂移。
来源: 诊断科学
声明:本平台注明来源的稿件均为转载,仅用于分享,不代表平台立场,如涉及版权等问题,请尽快联系我们,我们第一时间更正,谢谢!






