测量荧光是每个实时PCR反应的基础(见图1)。已经开发了许多不同的方法,其特异性和灵敏度各不相同。探针是反应中最具体的组成部分。

图1 | 集合纯化的人类甲肝病毒(HAV)的扩增情况
人类甲型肝炎病毒(HAV)从粪便中以三种稀释比(未稀释、10×和100×)进行扩增(蓝线;FAM/BHQ1探针)、阳性质控(P);FAM/BHQ1探针)和内部过程质控MS2(紫线;Cy5/BHQ3探针)加在所有样品中并使用水解探针技术。没有扩增的直线是HAV和MS2的水质控。所有检测组合显示的是对数线性表示的扩增曲线
(a)没有基线校正的扩增曲线显示观察到的原始荧光数据
(b)用CFX软件进行基线校正后的扩增曲线。请注意,基线估计受到高基线值的阻碍,直到第8循环。一个反应不能用CFX软件进行充分的校正。
(c)用LinRegPCR软件进行基线校正后的扩增曲线。扩增曲线的对数线性部分(WOL-线性窗口)的Cq读数由绿线(低于WOL上限的一个循环)和每条扩增曲线之间的交叉点呈现。最右边的粗线扩增曲线是(b)中存在问题的那条。
(*)MS2的处理方式是观察到一个最小的、恒定的信号,Cq35.6 ±1.1。
实时PCR发展的先驱之一Stephen Bustin介绍了一种分类,其依据是荧光信号产生的方式。但这意味着什么呢?这只针对特定的扩增物,还是也针对其他DNA合成产物?该分类根据荧光信号的特异性进行区分,是指示所有合成的DNA分子,还是只指向一个特定的扩增物。
1、非特异性化学反应
在非特异性化学反应中,荧光染料将与PCR过程中合成的所有dsDNA结合,无论这是否是特定的扩增物或(副)产品。各种类型的荧光染料可以通过不同的机制结合,例如,通过插层、离子结合和/或结合到「主槽或次槽」。
其中一些被用于PCR。溶液中的游离氟色体和那些与双链DNA结合的氟色体在发射方面有很大的不同。与双链DNA结合后,它们的发射要高得多,而不会增加背景。模型研究显示,浓度、离子强度和碱基顺序影响量子产率,即每个荧光色素产生的荧光量。除此之外,氟色素对Tm也有很大影响。
当双链构型因变性而丧失时,氟染色体就会解离。因此,在每个循环中氟色素被释放,并与新合成的双链分子结合。荧光的测量发生在延伸期结束时,就在变性之前。
在这一时刻,所有的双链PCR产物都完全「装载」了荧光素。非特异性化学反应不能区分特异性扩增物和其他DNA合成产物,这些产物可能是由于例如误植、重组或引物二聚体的形成而引起的。有时,在引物上使用5'端猝灭剂以防止引物二聚体发出荧光。
SYBR® Green I被广泛使用,它是成本最低的与DNA分子的「小沟」结合的荧光色素。SYBR® Green I在相对低的浓度下会抑制PCR(被错误地命名为「对PCR有毒」)(见图2)。

图2 | 对插层染料的qPCR干扰的灵敏度
六种不同的市售荧光剂以不同的浓度被使用,并与Cq值作图。看来SYBR® Green I只能在一个非常小的浓度范围内使用。在这个范围之外,Cq的急剧上升表明对PCR的干扰。所有的实验都是在相同的条件下进行的。
SYBR® Green I是一种非饱和染料,并不是所有的潜在结合位点都被占用。描述了熔解曲线分析过程中染料的重新定位。SYBR® Green I的缺点已经被第二代荧光染料(EvaGreen®, LC Green®, Pico Green®, BEBO, SYTO®)所超越,显示出对Tm的影响较小,对PCR没有抑制作用,荧光信号的稳定性较高,对双链DNA有饱和作用)。
LC Green是高分辨率熔解曲线分析的替代品;SYTO®-82更适合于检测低拷贝的靶点,特别是在qPCR中需要更高的动态范围时。EvaGreen®可以代替SYBR® Green I用于所有的应用(图3)。
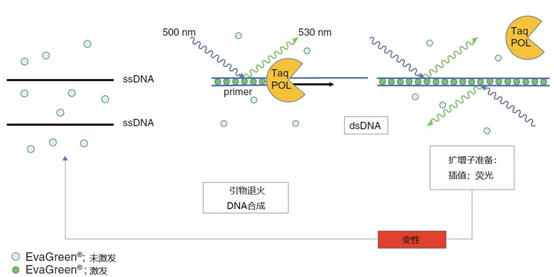
图3 | 非特异性化学反应;实时 PCR 中 EvaGreen®与 dsDNA 的结合
EvaGreen®是一种荧光染料,只有在与dsDNA结合时才会发出荧光。在实时PCR中,引物与靶点DNA退火后进行DNA的合成。与引物退火同时,EvaGreen®分子与dsDNA片段结合。Taq-DNA聚合酶(TaqPOL)的链延伸意味着EvaGreen®与扩增子的结合。EvaGreen®结合的越多,在延伸阶段结束时测量的荧光就越多。所有的 EvaGreen®将在变性时解离,在新的退火和延伸阶段期间和之后,将开始新的荧光染料结合。由于 EvaGreen®与所有的 dsDNA 结合,由 Taq-DNA 聚合酶合成的副产品会对荧光的测量产生影响。这降低了特异性,但在优化过程中,可以通过熔解曲线检测它们的存在。后者有助于找到最佳的实时PCR条件
在诊断中,非特异性化学反应特别是在实时PCR的优化和熔解曲线分析中使用(见图4b和图5)。
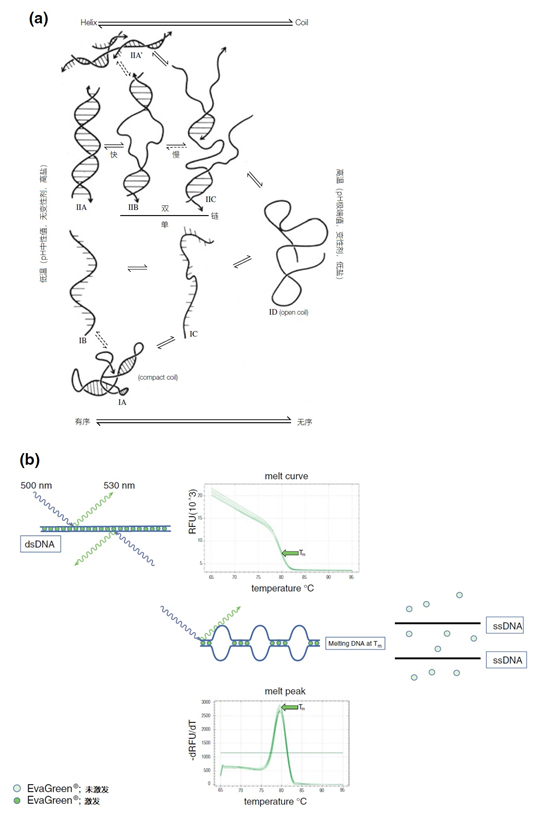
图4 | 重新变性和变性条件下dsDNA的变性和重新变性。dsDNA的构型在很大程度上取决于化学和物理因素
(a)高温、极端的pH值、变性物质(如甲酰胺)和低浓度的盐会破坏Watson-Crick碱基配对,导致单链分子处于开放线圈结构(ID)。在适当的条件下,原始形式的再熟化是可能的;然而,在复杂的、高分子量的DNA中,这个过程最初会运行得很慢。当开环结构在冰上被冷却时,两条链都不会再变性。在一定条件下,将形成一个具有内部碱基配对的紧凑线圈(IA),或者分子将保持在开放线圈配置(IB)。对核酸构型的操作是杂交和PCR测定的基本原则。
(b)用荧光染料(如EvaGreen®)观察dsDNA的变性情况(见图2.14d)。从65℃到95℃小幅度升温,使两条DNA链之间的碱基配对逐渐解开;富含AT的区域最不稳定,首先成为单链。相应地,荧光染料也会丢失。超过一定的温度,取决于碱基的组成和DNA的大小,所有的荧光色素将回到溶液中,荧光将变得最小。当使用荧光数据和温度时,熔融曲线可以直观地显示这一过程。当50%的碱基被解离时,荧光的损失是最迅速的。这个点要用数学方法计算,叫做Tm。
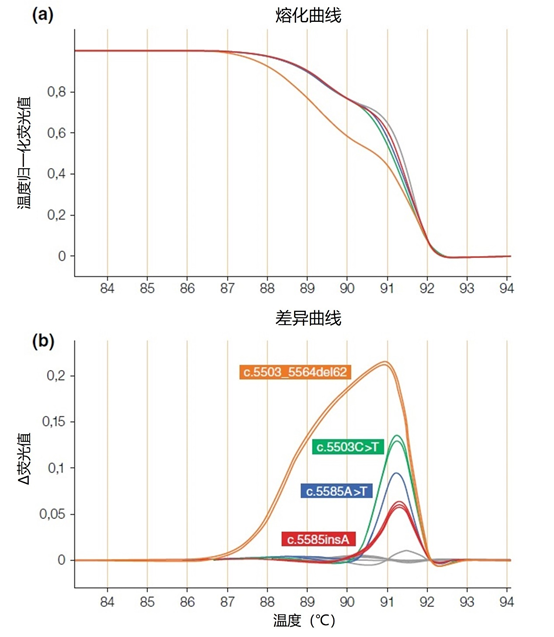
图5 | 高分辨率熔解曲线分析(HMRA)
(a)从BRCA1基因第24外显子产生的扩增子的熔解曲线,来自患者和质控组,含有62 bp的缺失(c.5503_5564del62),和点突变。有缺失的熔解曲线(橙色)显然有一个偏离的熔解行为
(b)突变异样品(橙色)和突变异样品c.5503C>T(绿色)、c.5585A>T(蓝色)和c.5559insA(红色)的荧光差异图。野生型(灰色)被用作参考,在Y=0处产生水平线。
2、特异性化学反应
荧光色素标记的oligo、-PNA或-LNA是特异性化学反应的基本原理。荧光源于序列特异性杂交到扩增物上,例如,由标记的引物或探针(见图6)。只有最后一类,即标记的探针,可以区分引物二聚体和其他DNA产物,以及预定的扩增物。事实上,荧光信号是序列确认的步骤。
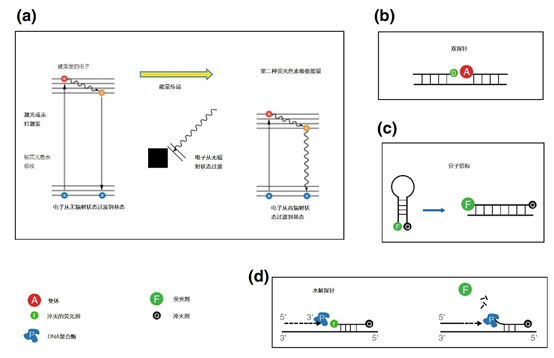
图6 | 傅氏共振能量转移(FRET)
两个氟色体和激发电子之间的能量转移参与了FRET。
(a)首先,一个供体(D)氟色体被激发。然而,第二个氟色素,允许FRET,阻止受激电子正常返回到与光的发射有关的基态。相反,供体(D)的激发电子无辐射地返回到基态,而它的高能量含量则被转移到第二个受体氟色素上,其中的电子反过来成为激发电子。两个荧光体的特定组合导致荧光的转移或信号的猝灭。
(b),(c),(d)显示了FRET在双探针(b)、分子信标(c)和水解探针(d)的应用。
注释b 受体荧光剂(A)的荧光。供体(D)将其辐射能量转移到受体(A)上。受体会变成荧光(A),但只有当带有供体或受体的两个探针串联杂交时才会这样做。供体(F)将其辐射能量转移到受体(Q)上。猝灭体Q吸收了激发能量,一个电子将被激发。这个电子也会返回到它的基态,而不发射光,只要淬体(Q)和荧光剂(F)保持在彼此的附近,就不会观察到荧光。一旦F和Q发生物理分离,能量转移就不再可能,F将发出荧光。
特异性化学反应使用FRET作为检测荧光素的基本原则。最重要的类别是荧光的猝灭和增强(图6)。
在猝灭中,荧光被另一种荧光剂所熄灭,只有当荧光剂离开猝灭剂的附近时才会出现荧光。准确区分特定的荧光和背景是非常重要的。与第一代猝灭剂(TAMRA,DABCYL)相比,猝灭剂BHQ 1至3使用得更频繁(图7)。由于猝灭作用(信噪比)的改善,测量将变得更加敏感和更加可靠。
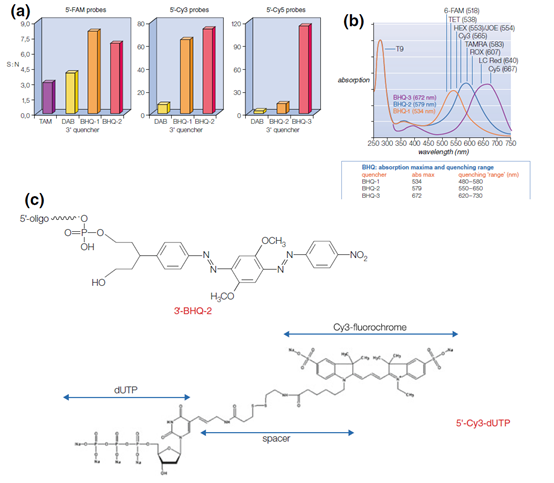
图7 | 荧光剂和猝灭剂的信噪比 荧光剂和猝灭剂的信噪比分别与第一代和第二代猝灭剂TAMRA和DABCYL以及一系列Black Hole猝灭剂(BHQ)1至3进行比较。
(a)吸收,其中猝灭剂的长度应与荧光色素的最大发射同步。由于这个原因,荧光剂和猝灭剂之间总是有一个牢固的融合。从用FAM(a)、Cy3(b)和Cy5(c)标记的探针的信噪比可以得出结论,BHQ猝灭剂能够比第一代猝灭剂(TAMRA/DABCYL)更有效地吸收电子的下落。信噪比表明了无发射过渡到地相的有效性。已知的氟色体和相关的猝灭剂。
(b)BHQ 1、2和3与相关的氟色素的吸收光谱。
(c)在合成探针的过程中,氟色素被连接起来(见3.3.1节和图10)。Cy3连接在5′端,猝灭剂BHQ2连接在3′端。这些基团将通过化学合成耦合到探针上。来源于Biosearch技术。(a)寡核苷酸探针中的淬火机制(经许可;重新绘制);(b)Black Hole猝灭剂;Sigmaaldrich.com(经许可);(c)不可追溯的来源
双探针技术的基础是由一个3′-供体和一个5′-受体组成的两个探针的串联靶向结合而产生的荧光增强。在溶液中,只有非结合探针的非常微弱的荧光被测量。
采用水解技术的5'-核苷酸酶测定法(见图8)和双探针杂交法(见图9)都依赖于相同的原理,即与预定扩增物的序列特异性结合。
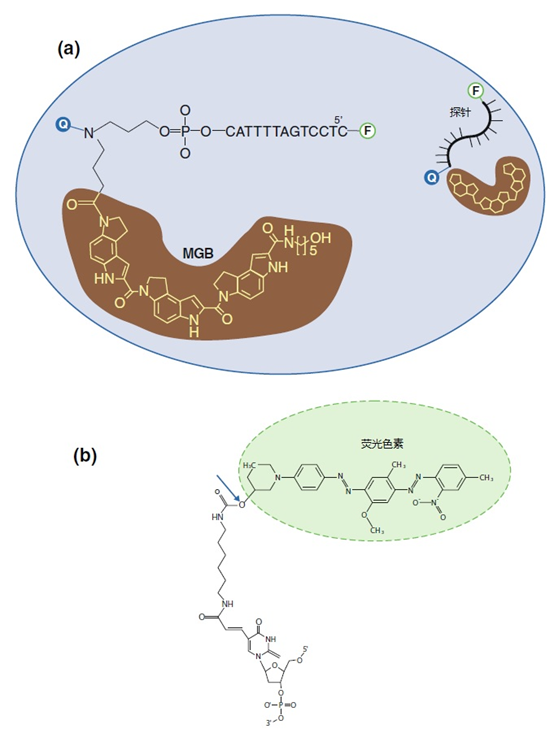
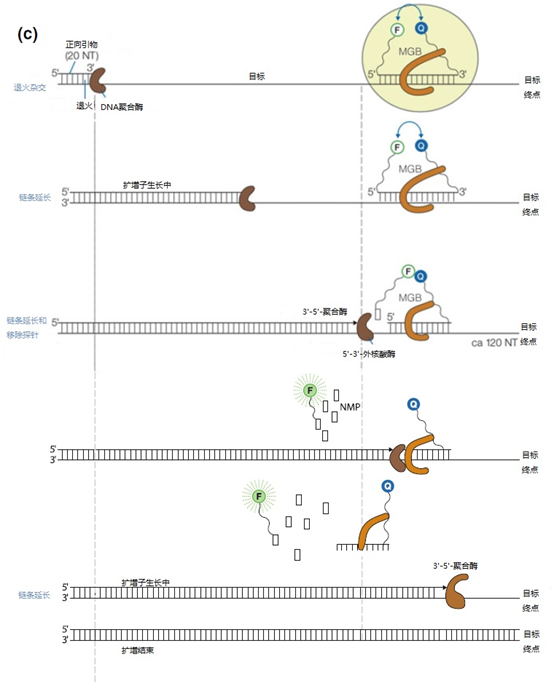
图8 | 用水解探针猝灭
一旦带有分离核苷酸的荧光标签在自由溶液中释放,就会开始发出荧光。猝灭剂也处于隔离状态,但与荧光色素的距离太大,无法猝灭荧光
(a)5′-氟色素(F)、MGB(三肽)、猝灭剂(Q)和间隔物的分子组织都在寡聚物的3′端。图8b中概述了连接体。
(b)连接在连接体上的荧光色素(F)的分子组织,通过在寡核苷酸的5′端加入胞嘧啶-dUTP。
(c)实时PCR中5′-核酸酶活性的原理。靶点变性后,引物和水解探针都会与其中一条DNA链杂交。探针的设计方式是使其比引物更快速有效地杂交。探针必须对扩增物有很高的特异性。探针的位置在靶点的5′端附近。水解探针在溶液中,由于附着在探针上的非荧光猝灭剂(Q)的猝灭作用,不会自动发亮。一旦寡核苷酸与靶点序列完全退火,DNA的合成就从引物(和探针)的3′端开始。当酶遇到水解探针时,聚合酶的5′-3′-外切酶域将变得活跃,并逐个碱基地去除探针。在这个过程中,DNA的合成继续进行。
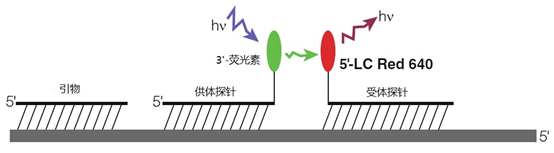
图9 | 双探针杂交(特异性化学反应反应)
用引物和头对尾的探针杂交的扩增物示意图(锚式杂交)。来源 不可追溯的来源(重新绘制)
然而,这两种方法在产生荧光的方式上有很大不同。水解探针部分碎裂成单核苷酸,荧光色素和猝灭附着在上面,就会消失,而在双探针技术中,只有当两个探针杂交,供体和受体荧光色素之间有可能相互作用时,才能观察到荧光。只有后一种方法适用于熔解曲线分析。
杂交的一种特殊形式是分子信标,它被稳定的发夹结构所猝灭,只有在变性和随后与扩增物的互补序列结合后才产生荧光(见图10)。所有这些都是序列特异性实时PCR测定的例子,基于非杂交的氟铬标记的探针的猝灭和杂交后序列特异性信号的存在。基于探针的方法非常适用于使用qPCR技术的分子诊断。
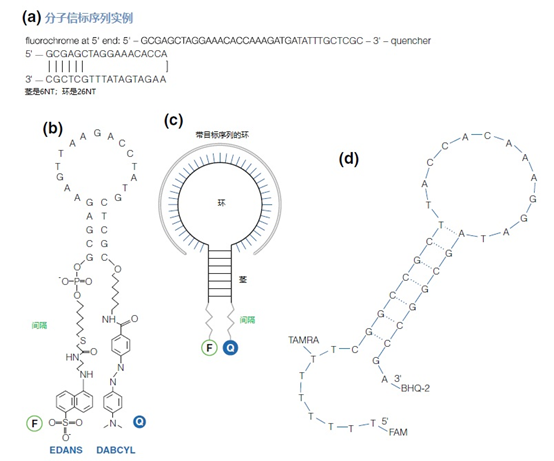
图10 | 分子信标
分子信标的主要结构和示意图显示了荧光剂(F:EDANS)和猝灭剂(Q:DABCYL)。BHQ和Cy3的结构式,见图3.27。
(a)分子信标的例子。分子的3′和5′侧的垂直线表示互补发夹区。
(b)经典的分子信标。间隔物在寡核苷酸的5′或3′端一侧耦合,另一侧是荧光染料(F)或猝灭剂(Q)。间隔物由一定长度的碳水化合物组成,以获得彼此之间的紧密接触,达到最佳的猝灭效果[16]。
(c)分子信标的示意性概述。用于靶点杂交的互补碱基形成一个环形结构(发夹)。
(d)带有额外核苷酸间隔物的荧光色素的位置概述,以改变FAM或TAMRA与BHQ猝灭剂的位置。
发夹引物(见图11)是特异性化学反应的一个例子,没有确认扩增物特异性序列上的杂交,而猝灭也适用于非内置引物。在这种技术下,引物二聚体或误植后也会出现荧光。
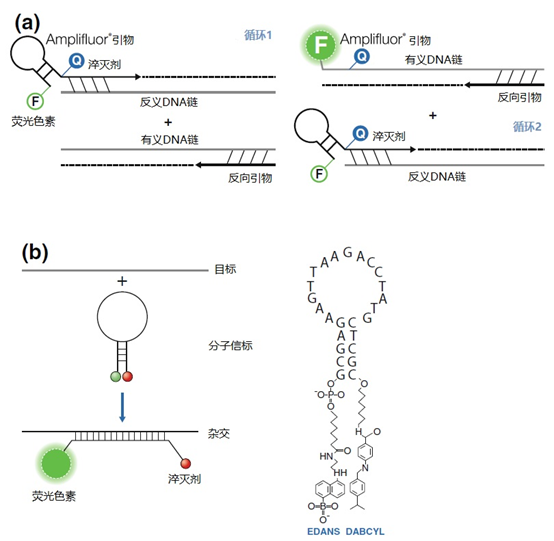
图11 | 实时PCR中引物和探针的猝灭
引物(a)和探针,即分子信标(b)在溶液中不发亮,这是猝灭的结果。报告基团和猝灭者在彼此附近,从而交换激发电子(猝灭)。一旦发夹引物在PCR过程中被拉长(a)或探针与扩增物退火(b),荧光剂和报告基团将被物理分离并发生荧光。
来源: 诊断科学
声明:本平台注明来源的稿件均为转载,仅用于分享,不代表平台立场,如涉及版权等问题,请尽快联系我们,我们第一时间更正,谢谢!






