1、用荧光染料进行浓度测定
有各种技术和相关的荧光色素可用于检测核酸,如图1和表1所示。一些应用能够分辨出单链和双链DNA、不同基质和溶液中的DNA/RNA。溶液中的核酸浓度可以通过荧光染料来确定。
它们还可以用来在电泳技术中使核酸可视化,或在实时PCR中测量荧光量。
荧光素也被用作引物、探针和单核苷酸的标签。尽管很多制造商表示,与溴化乙锭相比,其产品的致突变性已严重降低,但仍然必须极其谨慎地处理这些材料。
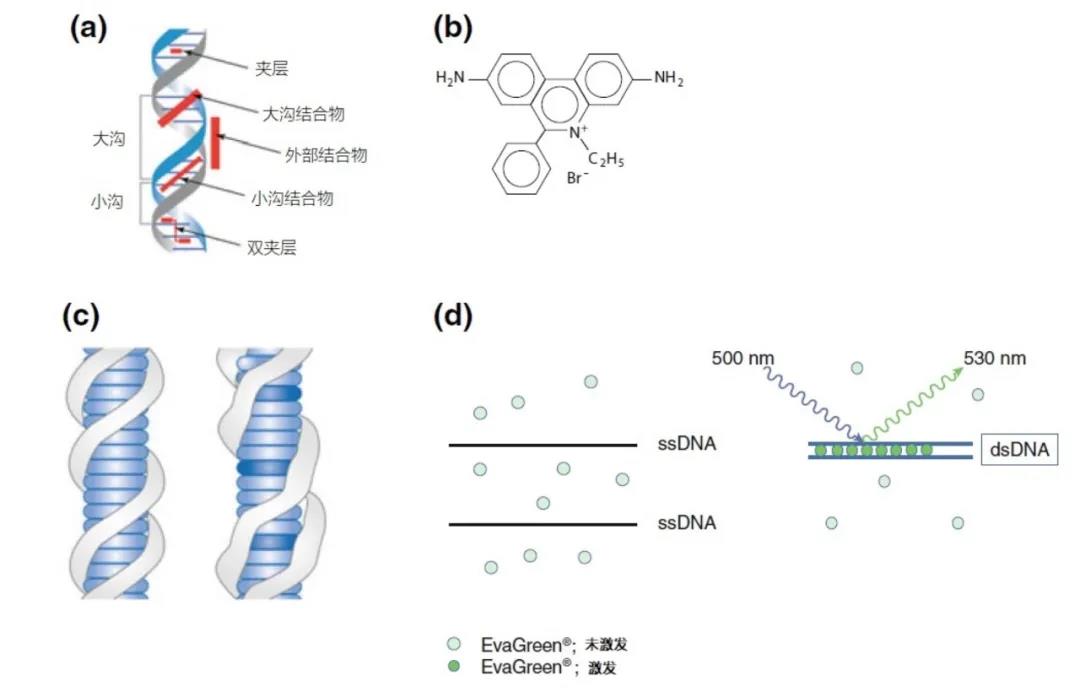
图1|DNA结合染料和溴化乙锭和EvaGreen®对插层的进一步解释
a 五种不同类型的DNA结合染料。
b 2,7-二氨基-9-苯基-10-乙基溴化镧的结构式,更好地称为溴化乙锭。
c 溴化乙锭(深蓝色圆片)与双链DNA的螺旋结构交错。浅蓝色的圆片表示各个成对的碱基(氢键)。
d EvaGreen®不与单链DNA(ssDNA;开放圆圈)结合,当用500nm的光照射其吸收最大值时,几乎不发光。相反,EvaGreen®对双链DNA(dsDNA;封闭的圆圈)的吸收达到饱和,在530nm处发出强烈的荧光。
1.2、核酸检测
溴化乙锭被添加到凝胶和/或电泳缓冲液中,是一种插层的DNA染料,主要用于电泳。荧光染料在通过凝胶迁移时通过插层与dsDNA结合。
凝胶电泳后,可以用摄影、图像分析或光谱法确定被染色的DNA片段的位置。如果与溴化乙锭相比,SYBR® Green I、EvaGreen®和其他DNA染料的灵敏度要高得多。
在凝胶电泳中使用时,即使是少量的dsDNA也可以被看到。
1.3、用荧光染料测定核酸的浓度
DNA和RNA的浓度可以使用校准曲线在20 ng/mL-3 μg/mL的范围内确定。这种类型的测定的灵敏度取决于荧光色素的摩尔消光率、每kb结合多少染料分子以及最后,要检测的核酸的类型(DNA、RNA、ss、ds)。
在过去的十年中,许多荧光染料已经可以用于测定DNA和RNA,并具有(非常)高的灵敏度。知名的例子是PicoGreen®和SYBR® Green I(表2.6)。这两种染料可以测量0-2 ng/mL(50 pmol)的DNA,比溴化乙锭的检测限低103。
高分子核酸和寡核苷酸浓度的分析
溶液中的DNA浓度计算公式:浓度(μg/mL)=(A260-A320) × 稀释系数 × 50 μg/mL。
溶液中的RNA浓度计算公式:浓度(μg/mL)=(A260-A320) × 稀释系数 × 40 μg/mL。
溶液的浊度可以用A320进行校正:
DNA产量(μg)= DNA浓度(μg/mL) × 总样品量(mL)。
寡核苷酸的浓度是由A260计算的。各个核苷酸的分子消光系数被用来计算寡核苷酸的浓度,具体如下:
寡核苷酸浓度(mol/L)=(A260)/Em。
Em是累积消光系数。这是由单个寡核苷酸的所有分子消光系数相加确定的。在260纳米的1厘米比色皿中,A = 15200 L/mol cm,G = 12010 L/mol cm,T = 8400 L/mol cm,C = 7050 L/mol cm,例如,20个核苷酸的寡核苷酸,5A、4G、4T和7C。Em = (5 × 15200 + 4 × 12,010 + 4 × 8400 + 7 × 7050) L/mol cm。
另一种方法是:寡核苷酸浓度(pmol/μL)=A260/(100/1.5nA + 0.71nC + 1.2nG + 0.84nT)。
1.4、基于染料结合的核酸识别
自由的 EvaGreen®或SYBR® Green I 在溶液中是没有荧光的。然而,当它与dsDNA结合时,会发出强烈的荧光。如图1 d所示。
虽然 SYBR® Green I 对 RNA 和 ssDNA 有一定的亲和力,但它的荧光要小 25-100 倍。
因此,它非常适用于实时PCR和分析DNA分子的熔解行为。由于EvaGreen®和LC Green®可以使dsDNA分子完全饱和,在需要高分辨率的熔解曲线分析时,它们是首选。
SYBR® Green II是一种RNA染料,其特性与用于DNA的SYBR® Green I相当。
2、用荧光DNA和RNA染料
测定核酸的含量
荧光染色剂可以通过氮基分子的某些碳原子与核苷酸结合。也可以通过酶的作用将这些氟染色体纳入核酸中。
荧光色素的许多应用开始于将活性基团与之耦合,通过这些基团可以在给定的地方连接到引物和探针上,例如在寡聚物的3′和5′端。灵敏的检测系统使用CCD测量它们的荧光。表1显示了分子诊断中使用的一些荧光染料。
表1|常用的氟色素。荧光色素可以连接到核苷酸三磷酸酯的寡核苷酸上,如UTP、ATP、CTP,或用于qPCR、测序(SEQ)、核酸的定量和熔解曲线分析(MCA),或用作淬灭剂
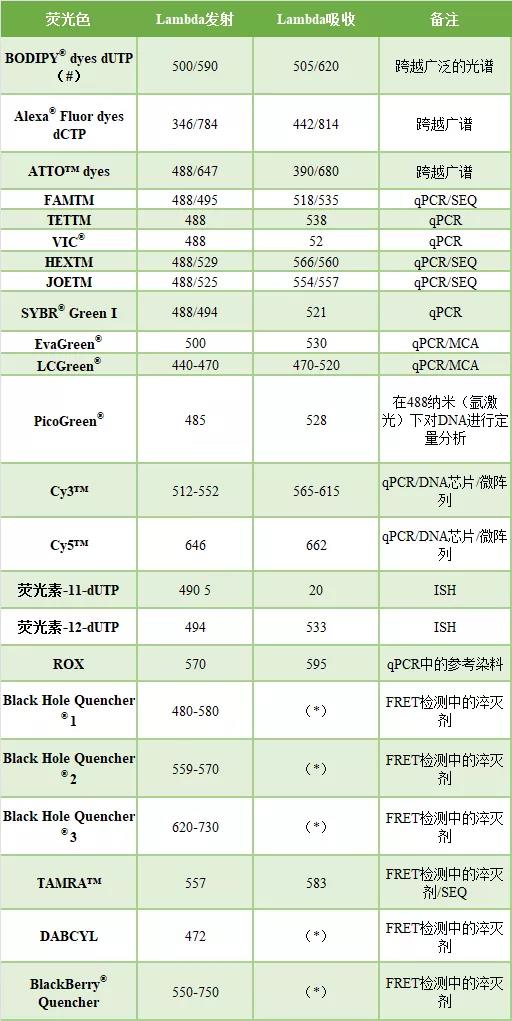
FRET:福斯特共振能量转移
ISH:原位杂交
(*)当淬灭是结果时,发射波长不相关
(#) U(尿嘧啶)也可以被其他氮基取代,例如 「A」
根据所应用的技术,这种荧光可以直接测量,或者只在某些专门的配置下测量。这些技术对实时PCR特别重要,我们也将在后续的文章中进行讨论。
FRET是一个物理过程,当某些氟色体在激发条件下(使用特定波长的单色光)可以与对方的分子云相互作用时,就会发生这种现象。
FRET始于一个氟色素的激发,将一个电子转移到激发态。这个受激电子在返回基态时将其能量转移到第二个氟色素上,如图2a和图3。
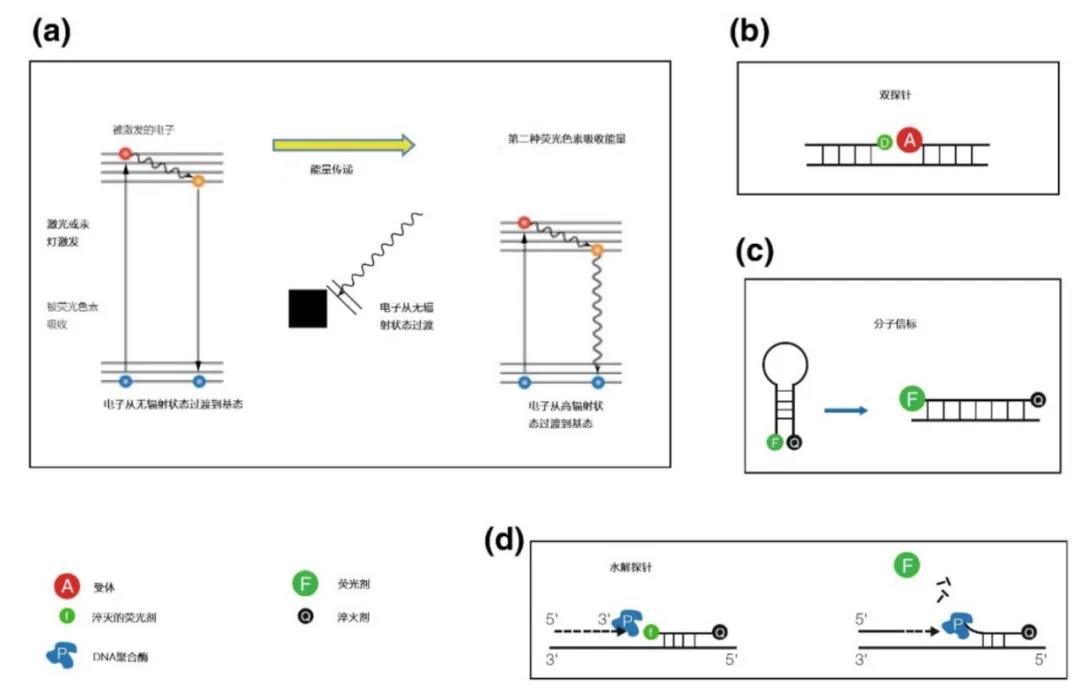
图2|傅氏共振能量转移(FRET)
两个氟色体和激发电子之间的能量转移参与了FRET。
a 首先,一个供体(D)氟色体被激发。然而,第二个氟色素,允许FRET,阻止受激电子正常返回到与光的发射有关的基态。相反,供体(D)的激发电子无辐射地返回到基态,而它的高能量含量则被转移到第二个受体氟色素上,其中的电子反过来成为激发电子。两个荧光体的特定组合导致荧光的转移或信号的淬灭。
b, c, d 显示了FRET在双探针(b)、分子信标(c)和水解探针(d)的应用。
受体荧光剂(A)的荧光。供体(D)将其辐射能量转移到受体(A)上。受体会变成荧光(A),但只有当带有供体或受体的两个探针串联杂交时才会这样做。供体(F)将其辐射能量转移到受体(Q)上。淬灭体Q吸收了激发能量,一个电子将被激发。这个电子也会返回到它的基态,而不发射光,只要淬体(Q)和荧光剂(F)保持在彼此的附近,就不会观察到荧光。一旦F和Q发生物理分离,能量转移就不再可能,F将发出荧光。
随后,第二种荧光色素的一个电子被激发。有两种不同的途径是可能的:
➤ 具有高量子产率的第二种荧光色素的电子被激发,导致强烈的荧光,同时返回到基态;
➤ 通过一个被称为淬火的过程,第二种氟色素的电子发生了较少的辐射,回到了基态。因此,所有的能量都通过产生A.O.热而被传播,如图3所示。
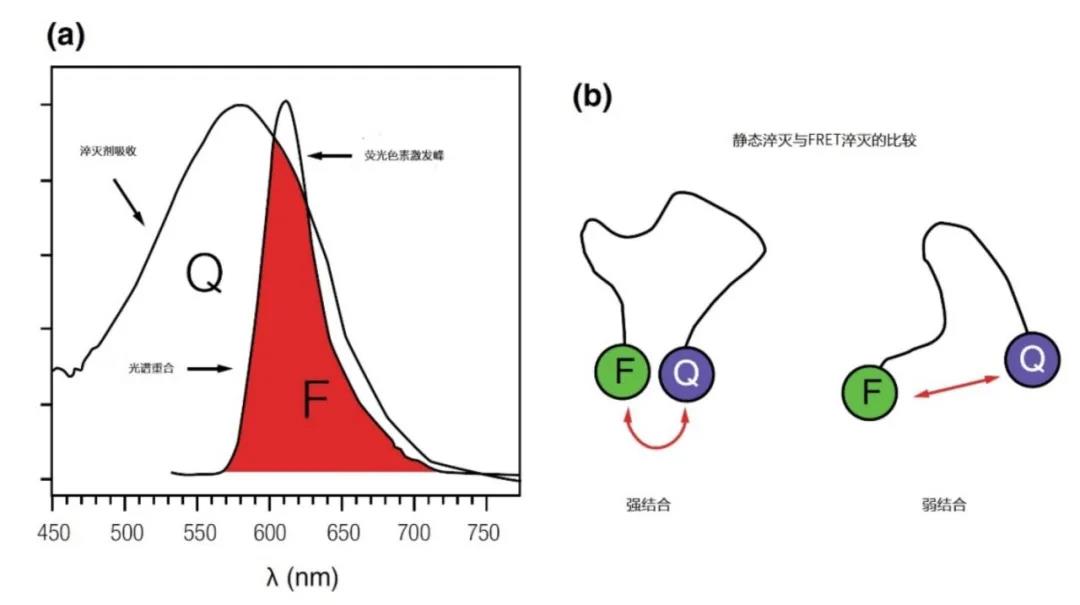
图3|荧光的淬灭
a 在淬灭过程中,受激电子的能量在回到其地相时不会透光,而是转移到另一个荧光体上。当淬灭剂(Q)和受体/荧光剂(F)在其附近(0.1纳米)时,淬灭是最有效的,这取决于F/Q的组合以及淬灭剂吸收和报告者/荧光剂的发射之间的高度光谱重叠。
b 在大多数形式的淬灭中,主要是发生所谓的FRET淬灭。由于几种弱的非共价相互作用,F和Q会在对方附近出现,也称为碰撞淬灭。当两者处于正确的方向和相互之间的距离时就会发生淬灭。F和Q之间的强疏水芳香基团在其他F和Q的组合中出现,如支持信标结构(也见图3.24)。此外,这两个分子之间的静态耦合和变化的吸收光谱也会发生,这被称为:静态淬灭(这种相互作用对温度和溶剂更敏感)。在实践中,这两种形式的组合经常出现。作为比较,两个后续分子之间的距离是0.34纳米。10个核苷酸之间的距离正好是34埃(dsDNA的螺旋结构中的一个扭曲)。
不考虑荧光色素的特性,即荧光或淬灭,这种相互作用只有在光谱重叠(它们发射或吸收的波长)和两个荧光色素之间的物理距离足够近时才能发生(在埃斯特伦距离),如图3所示。
引物和探针的设计方式使这种相互作用成为可能。这种FRET原理被应用于几种PCR技术。例如杂交探针、分子信标、水解探针和一些PCR引物,如图2b~d所示。
好了,以上就是今天分享的全部内容,如果大家有什么疑问,欢迎在后台给我们留言,或者加入我们一起讨论,若觉得文章不错,也请关注我们,以免错过后续更新~
来源:诊断科学
声明:本平台注明来源的稿件均为转载,仅用于分享,不代表平台立场,如涉及版权等问题,请尽快联系我们,我们第一时间更正,谢谢!






