在上一篇文章当中,我们介绍了PCR的干扰因素,今天我们将介绍核酸提取的质量标准和检测方法。
1、核酸提取的质量标准
为分子诊断分离的核酸需要有尽可能高的质量和纯度。在分离过程中,干扰物质去除不充分和对目标区域的损害是最大的风险。
由于3′-5′-糖-磷酸盐桥的水解,很容易发生单/双链断裂和/或碱基损失的片段。这些问题可能发生在隔离之前、期间和之后(浓缩期间)。
采样后和运输过程中,酶促过程(DNase和RNase)是最重要的。在分离和储存过程中,非酶性水解造成的片段化增强了出现假阴性结果的机会。特别是,反复的冻融循环是(可避免的)风险。
核酸的质量、纯度(在分离和提取程序之后)和浓度可以通过各种方法确定。所需的浓度尤其取决于诊断问题。
在作为阳性对照的材料中,DNA或RNA的浓度,或目标的数量是已知的。
例如,在有未知病原体的临床材料中,浓度测量是不可能的,也没有必要,而只有存在或不存在是结果。相反,在法医材料或确定基因表达不足/缺失的样品中,测量样品中的浓度是必要的。
紫外线吸收(OD)大多被使用/应用,凝胶电泳也是如此,有时使用DNA/RNA插层染料进行测量。
紫外吸收是最简单和容易的一种。它也能提供最多关于污染性蛋白质和其他物质被去除程度的信息。紫外测量并不能提供样品中存在的目标物的数量信息。
例如,一个众所周知的问题是少量的原核生物目标DNA或RNA在大量的真核生物(宿主)DNA中无法被检测到。
对DNA和RNA样品可能的污染物的吸收最大值:
➤ 230纳米:胍盐(用于促进DNA附着在硅酸盐上)和苯酚;
➤ 280纳米:酪氨酸和色氨酸;在280纳米处的吸收表明蛋白质仍然存在;
➤ 320纳米:浊度,为校正浊度,确定A260-A320。
2、电泳法
电泳可以很好地了解完整核酸的存在,因为它是根据分子大小来分离的。低分子产品表明是水解的核酸。
在DNA中,存在大约10kbp的高分子部分是合适的材料的良好标志(见图5.13)。变性后,纯化的mRNA必须在产品尺寸为8-10kb时可见条带。18和28S rRNA条带是总RNA质量的指示,如图1所示。
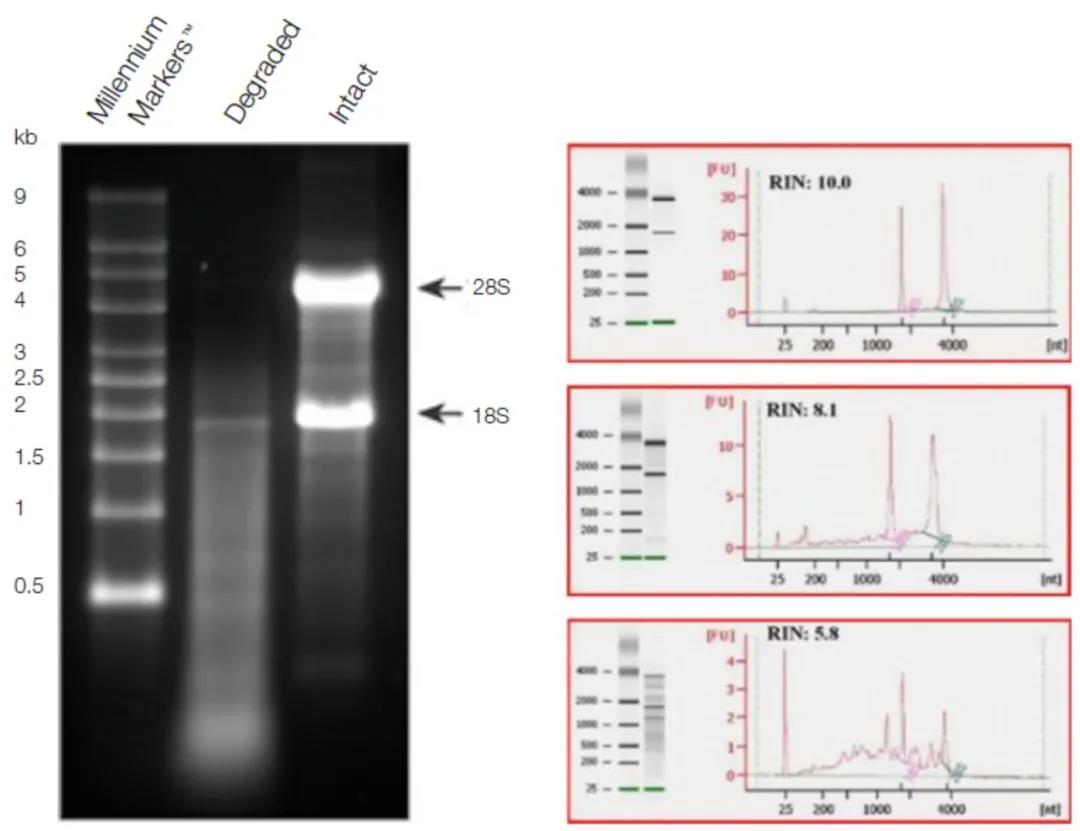
图1|使用变性电泳对RNA进行质量控制
a 使用福尔马林对总RNA进行经典的变性琼脂糖凝胶电泳。泳道1,分子量标记(细分为0.5-9kb);泳道2,水解后的片段RNA;泳道3,完整的RNA。
b 使用安捷伦生物分析仪进行RNA质量控制的凝胶扫描和电泳图像。RNA完整性编号(RIN)是对完整的RNA(28S/18S比率)和可能的片段之间平衡的定量测量。测量的依据是18S和28S RNA峰的峰面与背景的关系。
通过凝胶扫描可以进行量化:高的RNA完整性编号(RIN)表明RNA的质量好。
使用琼脂糖凝胶对DNA或RNA分离物进行直接电泳的灵敏度是有限的(25 ng/3 μL)。基于纳米技术的Bioanalyser(安捷伦)和类似的设备,在3 μL的体积中,分析测量范围为5-500pg,其灵敏度与紫外光谱仪处于同一数量级。
3、紫外光谱法
即使是最小的样品(1~2 L)也可以用紫外光谱法进行测量。DNA、RNA和单个核苷酸和寡核苷酸在260纳米处吸收紫外线。在1厘米的比色皿中,1.0的A260相当于50 μg/mL DNA和40 μg/mL RNA。
A260/A280比率提供了关于分离的核酸纯度的信息。纯的DNA和RNA的比率分别为1.8和2.0。
污染物如蛋白质、苯酚通常以不同的波长吸收光线。如果在230、280或320纳米处也有吸收,这表明分离物中存在杂质。如果该比率小于1.8,则可能是蛋白质的污染。A230/260的比率>1也说明了这一点。
好了,以上就是今天分享的全部内容,如果大家有什么疑问,欢迎在后台给我们留言,或者加入我们一起讨论,若觉得文章不错,也请关注我们,以免错过后续更新~
来源:诊断科学
声明:本平台注明来源的稿件均为转载,仅用于分享,不代表平台立场,如涉及版权等问题,请尽快联系我们,我们第一时间更正,谢谢!






