说到兔单抗,大多数人都不会陌生。兔单抗的应用已经遍布基础研究、生物药开发、体外诊断等各个领域。那么兔单抗和鼠单抗有什么区别?兔单抗有什么独特的优势?在兔单抗开发平台角度又有什么最新的进展?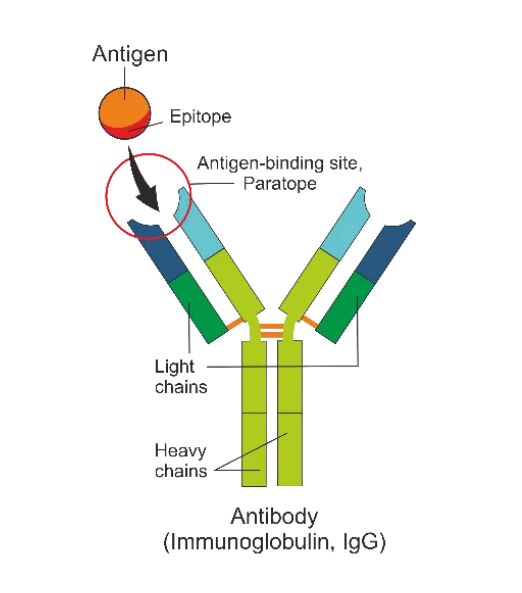
IgG抗体结构示意图
让我们来一探究竟!
首先,在分类学中,兔属于兔形目(order Lagomorpha),在进化关系上与大鼠和小鼠所属的啮齿目(order Rodentia)关系较远。兔抗体能够识别人类抗原中不能够被鼠单抗识别的抗原表位(epitopes),显著的增加了可使用的表位的数量,同时也有利于开发针对于人和鼠同源蛋白的抗体。
其次,兔对小分子和半抗原(haptens)会产生明显的免疫反应,而在啮齿动物中则不会产生明显的免疫反应。
第三,现在使用的绝大部分小鼠品系为近交系(inbred),而兔的近交品系则十分缺乏。近交品系会导致免疫反应多样性的显著降低。针对相同人类抗原的鼠和兔单克隆抗体的免疫组化(immunohistochemistry,IHC)结果表明,兔的单克隆抗体始终表现出比鼠单克隆抗体更高的灵敏性。
第四,现在通用的单克隆抗体生产技术均需要从脾脏,骨髓或血液中收集B细胞。而兔的个体显著大于鼠的个体,因此单个的动物个体中获得的B细胞的数量更高。
第五,兔的抗体产生及多样化的遗传学机制与人类和小鼠有着显著的不同。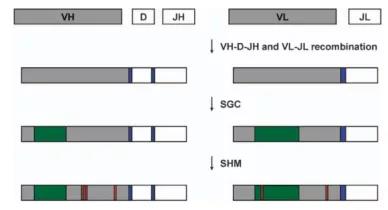
兔抗体库序列多样化的分子机制
兔B细胞和抗体库的个体发育,B细胞的三个主要不同的发育阶段。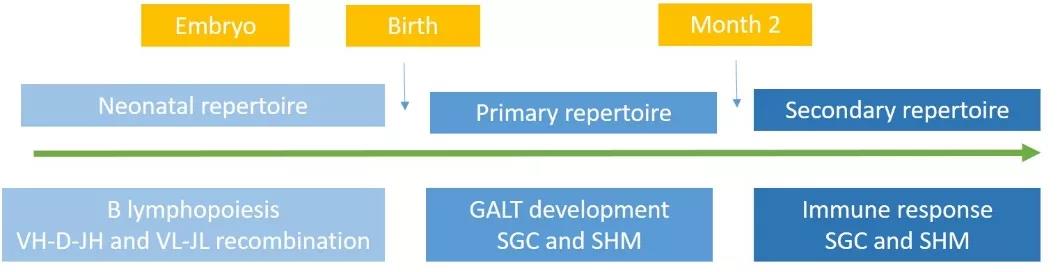
兔子免疫系统发展示意图
第六,兔 IgG 的简单特征使得抗体的分子克隆,工程化及人源化更容易,这在抗体药物开发中非常关键。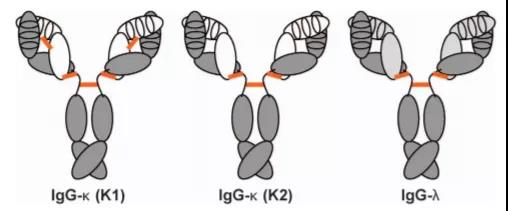
兔子IgG抗体天然结构示意图
目前对于兔单克隆抗体的开发一共有3大技术路线,一是传统的杂交瘤技术平台,该技术筛选的是抗体分泌型浆B细胞(Plasma B cells); 二是噬菌体展示技术,该技术直接对B细胞进行测序和建库,抗体序列来源可以是浆细胞也可以是记忆细胞(Memory B cells);三是基于B细胞的单B细胞直接测序或者基于B细胞的B细胞体外培养筛选后测序技术,该技术抗体序列来源可以是浆细胞也可以是记忆细胞。
1.杂交瘤技术
小鼠的杂交瘤技术于1975年建立,是小鼠单克隆抗体生产最常用的方法[1]。该方法通过收集免疫后小鼠B淋巴细胞,与源自BALB/c小鼠的骨髓瘤细胞(myeloma cell)融合,形成永生的杂交瘤细胞。通过有限稀释筛选杂交瘤细胞选择产生特定抗体的相应细胞克隆[1]。
自小鼠杂交瘤技术出现以来,科学家们一直在致力于寻找能够和兔的B淋巴细胞融合的兔源瘤细胞。由于缺乏兔骨髓瘤细胞系,兔的杂交瘤细胞生产遇到了一定的困难[2]。通过兔B细胞病毒转化产生骨髓瘤样细胞系的方法同样存在较大的困难[3]。1988年首次报道了通过小鼠和兔的异源杂交(mouse–rabbit heterohybridomas method)方法形成杂交瘤生产兔单克隆抗体的方法[2]。这种小鼠-兔异源杂交瘤存在着不稳定,效率低且无法长时间分泌抗体等弊端[4]。在1995年,科学家建立了一种通过兔-兔杂交瘤(rabbit–rabbit hybridomas)生产兔单克隆抗体的方法[5]。在v-abl/c-myc双转基因兔中发现了第一个稳定的兔浆细胞瘤细胞系240E-1。初始的240E-1细胞系被改进为240E-W及其后继细胞系240E-W2和240-W3,有着更高的融合效率且无内源性兔重链和轻链分泌。但与传统的小鼠杂交瘤相比,兔-兔杂交瘤同样不稳定且融合效率也相对较低,随时间推移而下降的IgG分泌较鼠同源杂交瘤更严重[6]。
2.噬菌体展示技术
噬菌体展示技术是一种于1990年代初期发明的生产单克隆抗体的方法[7][8]。丝状噬菌体(filamentous phage)的次要外壳蛋白(minor coat protein,pIII)可以在其N端被修饰,添加的肽段不影响噬菌体的感染性。这个系统由两个部分组成,一个是编码pIII融合蛋白的噬菌粒(phagemid)。噬菌粒是带有丝状噬菌体复制起始点的质粒。噬菌粒本身不含噬菌体蛋白编码基因。另一个组分是辅助噬菌体(helper phage)。辅助噬菌体有助于噬菌体基因组编码产生感染性噬菌体颗粒所需的所有蛋白质。这些辅助噬菌体含有经过修饰的包装信号,导致含有噬菌粒的噬菌体颗粒优先组装。
在这种技术中,从淋巴细胞中获得抗体V区基因库,克隆VH和VL的组合,通过与外壳蛋白融合的方式在噬菌体表面表达。选择表达有特定的单克隆抗体的噬菌体并用于相应检测。与受限制较大的杂交瘤技术相比,噬菌体展示技术不需要融合伴侣细胞,因此无物种特殊性,已经成功用于从已知免疫球蛋白编码基因的任何物种中进行单克隆抗体的筛选和分离[9][10]。
使用噬菌体展示技术挑选兔单克隆抗体的技术路线建立于2000年[11]。在文库构建期间发生的抗体可变区基因的随机组合导致在免疫反应期间在体内进化和选择的天然同源重链和轻链配对的丢失[12][13],造成抗体亲和力的下降。由于这种随机配对,来自初始抗体库的抗体通常需要在体外成熟以赋予抗体更高的亲和力和稳定性。
体外抗体展示技术不仅有噬菌体展示,也包括核糖体展示和体内展示平台,例如细菌、酵母和哺乳动物细胞表面展示[14][15]。
3.通过单细胞测序从单个兔B细胞中生成单克隆抗体
在单克隆抗体生产的过程中,杂交瘤和噬菌体展示技术均存在一些不足。
杂交瘤技术的细胞融合效率低,且一般细胞来源为脾脏,需要处死动物,而噬菌体展示技术则会导致重链和轻链的天然同源配对的丢失[16]。
通过单细胞克隆生产兔单克隆抗体的方法可以规避这两个缺点。基于单细胞克隆的兔单克隆抗体生产由以下几个步骤组成:
1. 从淋巴组织或外周血中分离单个的B细胞;
2. 提取RNA,通过逆转录扩增相应B细胞的cDNA;
3. 通过PCR从cDNA中扩增免疫球蛋白编码基因;
4. 将扩增出的基因克隆到表达载体中并进行测序;
5. 将测序后的质粒在哺乳动物细胞(如HEK293和CHO)或细菌(如大肠杆菌)中表达;
6. 通过ELISA评估相应抗体。
这个方法的最大优势是保留了抗体重链和轻链的天然配对,有利于产生具有高亲和力、特异性和稳定性的单克隆抗体。
兔的淋巴细胞库容很大,在进行单B细胞测序前必须经过富集才能提高测序成功率,重组表达后抗原阳性抗体序列获得的概率。记忆B细胞(memory B cell)和浆细胞/浆母细胞(plasma/plasmablast cell)是抗体的主要来源。已经有多种方法用于B细胞的筛选。
而对于B细胞的富集,目前常见的有传统的流式细胞分选技术,磁珠分选技术以及由Berkeley Light公司开发的基于光电定位系统的Beacon单B细胞抗体筛选平台技术,还有以Cyto-Mine为代表的微流控技术。因兔免疫系统的研究,相对比人和小鼠时间短且关注科研人群较少,目前为止没有特别成熟的可应用于兔浆B细胞分析和筛选的商业化抗体,这也限制了B细胞的前期筛选和重组后阳性率。
目前研究和已经开发出多种细胞分离的方法。有利用fluorescence-activated cell sorting (FACS)和内质网(endoplasmic reticulum,ER)特异性荧光染料对抗原特异性的浆细胞或浆母细胞进行识别和分离[17]的方法。有的利用免疫斑点阵列检测技术(immunospot array assay)进行抗原特异性兔单克隆抗体的检测[18]。有的基于荧光和显微操作(micromanipulation)对分泌有单抗原特异性抗体的兔浆细胞进行分离[19]。也有通过淋巴细胞淘选(lymphocyte panning)从外周血中分离抗原特异性的B细胞的方法[20]。最近也有一种双色抗原染色方法(two-color antigen staining method)用于识别抗原特异性兔记忆B细胞[21]。一种称为HybriFree的方法已经被成功的用于小鼠、兔和鸡的单克隆抗体的生产[22]。
4.通过B细胞体外培养技术获得兔单克隆抗体序列
因缺少B细胞不同分化时期的商业化筛选基因,兔B细胞的富集常用的有基于IgM,IgG类型分选,同时大部分是利用抗原进行富集和筛选。传统的流式分选或者磁珠分选,因为通量限制或者对原代B细胞造成不同程度的损失而导致获得有效抗体序列的概率比较低。金斯瑞抗体部在前人研究的基础创立了一种产生高亲和力单克隆抗体的方法。将经抗原富集的B细胞在体外进行培养1到2周的时间,然后通过上清进行抗原阳性的高通量筛选,对抗体功能进行分析和鉴定后进行测序,然后对获得的抗体序列进行重组转染验证。该方法最大程度保留了B细胞的多样性,提高了生产通量,同时提升了获得功能性抗体序列的概率和成功率。
资料来源:小桔灯网
声明:本平台注明来源的稿件均为转载,仅用于分享,不代表平台立场,如涉及版权等问题,请尽快联系我们,我们第一时间更正,谢谢!






