MDCG 2021-21 Rev.1
SARS-CoV-2体外诊断医疗器械性能评价指南
2022年2月修订版1
本文件已得到根据(欧盟)2017/745号法规第103条设立的医疗器械协调小组(MDCG)的认可。MDCG由所有成员国的代表组成,它由欧盟委员会的一名代表主持。
本文件不是欧盟委员会的文件,不能被视为反映欧盟委员会的官方立场。本文件中表达的任何观点都不具有法律约束力,只有欧盟法院才能对欧盟法律做出具有约束力的解释。

简介
本指导文件涉及SARS-CoV-2体外诊断医疗器械(IVDs)的性能评估,其背景是根据指令98/79/EC或法规(EU)2017/746进行合格评估。它涵盖了检测或定量SARS-CoV-2核酸、抗原以及检测或定量抗SARS-CoV-2抗体的器械。这些器械被统称为SARS-CoV-2 IVDs。该指导文件面向所有相关方,主要包括制造商,以及通知机构和主管部门、授权代表、其他市场经营者、专业和患者协会。
本指导文件的内容预计将成为未来几个月内根据(欧盟)2017/746号条例第9条通过的共同规范的基础。随着COVID-19大流行病的不断发展,这些内容可能会被调整,以考虑到不断变化的情况和不断增加的科技知识。
术语「IVD」、「器械」、「测定」和「测试」在本文中可互换使用。
通用考虑因素
在对SARS-CoV-2 IVDs进行性能评估时,应考虑到本节中的一般原则。
本指导文件中使用了以下术语:
➤ 诊断灵敏度是指器械识别与SARS-CoV-2有关的目标标记物存在的能力;
➤ 真阳性是指已知目标标记物为阳性的标本,并由器械正确分类;
➤ 假阴性是指已知目标标记物为阳性,但被该器械错误分类的标本;
➤ 诊断特异性是指器械识别与SARS CoV-2有关的目标标记物缺失的能力;
➤ 假阳性是指已知目标标记物为阴性而被该器械错误分类的标本;
➤ 真阴性是指已知目标标记物为阴性并被器械正确分类的标本;
➤ 检测限(LOD)是指可以精确检测到目标标记物的最小量,LOD是器械的分析灵敏度的一部分;
➤ 分析特异性是指该方法只测试目标标记物的能力;
➤ 核酸扩增技术(NAT):通过目标序列的扩增、信号的扩增或杂交来检测和/或定量核酸的方法;
➤ 快速测试是指定性或半定量的体外诊断医疗器械,单独使用或小批量使用,涉及非自动程序,并被设计为可提供快速结果;
➤ 分析程序的稳健性是指分析程序不受方法参数的微小但故意的变化影响的能力,并表明其在正常使用中的可靠性;
➤ 交叉反应(或交叉反应性)是指非目标分析物或标记物由于相似性而在测定中造成假阳性结果的能力,例如非特异性抗体与抗体测定的测试抗原结合的能力,或非目标核酸在NAT测定中的反应能力;
➤ 干扰是指不相关的物质影响测定结果的能力;
➤ 整个系统故障率是指当整个过程按制造商的规定进行时,出现故障的频率;
➤ 一线测定是指用于检测标记物或分析物的器械,随后可进行确认测定。仅用于监测先前确定的标记物或分析物的器械不被视为一线测定;
➤ 确认测定是指用于确认一线测定的反应性结果的器械;
➤ 补充测定是指用于为解释另一测定的测试结果提供进一步信息的器械;
➤ 病毒分型测定是指用于对已经知道的阳性样品进行分型的器械,不用于感染的初级诊断或筛查;
➤ 95%的NAT测定阳性临界值是指对国际参考材料(如世界卫生组织(WHO)国际标准或根据WHO国际标准校准的参考材料)进行连续稀释后,95%的测试运行结果为阳性的分析物浓度;该值描述了NAT器械的检测限(LOD)。
总体考虑
SARS-CoV-2 IVDs的性能评估应与最先进的器械直接比较。用于比较的器械如果在性能评价时已上市,应是带有CE标志的器械。对于SARS-CoV-2抗体测试,新器械应具有至少相当于同类型先进器械的整体性能,例如考虑基于所使用目标抗原和免疫球蛋白检测类别要求。
用于确定SARS-CoV-2 IVDs性能评估中的样品状态的器械应该是带有CE标志的最先进的器械。
SARS-CoV-2 IVDs的性能评估应在与欧洲人口相当的人群中进行。
如果在性能评估中发现不一致的结果,应尽可能通过以下一种或多种方式解决这些结果:在第三方器械中评估医疗器械的差异样本;使用替代方法或标记物;审查患者的临床状态和诊断信息;测试后续样本。
作为必要的风险分析的一部分,在对低阳性标本进行重复检测测定时,应确定导致假阴性结果的整个系统故障率。
灵敏度和特异性
在性能评估中使用的阳性标本应被选择来反映各自疾病的不同阶段、不同抗体模式、不同基因型、不同亚型、突变体等。
对于制造商准备用于血清或血浆的SARS-CoV-2 IVDs,阳性标本应包括25个阳性的「当天」新鲜血清样品(取样后 ≤ 1天)。
血清转换检测组合应从阴性血液标本开始,并且采样间隔应尽可能狭窄。如果无法做到这一点,制造商应在性能评估报告中说明理由。
性能评估中使用的阴性标本的定义应反映该器械所针对的目标人群,如献血者、住院患者、孕妇等。
特异性应该用目标标记物阴性的个体中反复出现反应性(即假阳性)结果的频率来计算。
对于制造商准备用于血清和血浆的SARS-CoV-2 IVDs,其性能评估应证明血清与血浆的等效性。就灵敏度而言,应至少采用25个阳性患者标本进行证明,就特异性而言,应至少采用25个阴性患者标本进行证明。
制造商打算用于测试血清或血浆以外的体液(如尿液、唾液等)的抗SARS-CoV-2 IVDs,应满足与血清或血浆器械相同的灵敏度和特异性要求。性能评估应在待批准器械和各自血清或血浆器械中测试来自同一个患者的样品。
对于从呼吸道分泌物中检测SARS-CoV-2的IVDs,其在所有声称标本类型上的性能应与鼻咽拭子的NAT测试进行比较。
干扰和交叉反应
制造商应选择潜在干扰物质进行评估,同时考虑到试剂成分和器械配置。制造商应在适用的情况下包括以下标本,如:代表相关感染的标本;多胎标本,即有过一次以上怀孕的妇女,或类风湿因子(RF)阳性患者的标本;含有表达系统成分人类抗体的标本,如抗大肠杆菌或抗酵母菌。
抗凝血剂
对于打算使用血浆的SARS-CoV-2 IVDs,性能评估应确认器械在使用制造商指出的与器械一起使用的所有抗凝剂的性能。每种抗凝剂应至少有50个血浆标本(25个阳性和25个阴性)来证明这一点。
批次测试
对于SARS-CoV-2抗原和抗体测试,制造商的批次测试标准应确保每个批次都能一致地识别相关的抗原、表位和抗体,并适用于声称的标本类型。
自我测试
用于自我测试的SARS-CoV-2 IVDs应满足与各自专业使用的器械相同的灵敏度和特异性要求。性能评估的相关部分应该由适当的非专业人员进行(或复测),以确认器械的操作和使用说明。为性能评估选择的非专业人员应能代表预期的用户群体。
具体考虑因素
下表列出了各种类型的SARS-CoV-2 IVDs的具体注意事项。
表1指的是以下针对SARS-CoV-2抗体(抗SARS-CoV-2)的一线测定方法(包括快速测试)。仅有IgG,IgG与IgM和/或IgA结合,以及总抗体。
表2是指检测抗SARS-CoV-2 IgM和/或IgA的测定(包括快速测试)。
表3指的是抗SARS-CoV-2的确认或补充测定。
表4指的是抗原SARS-CoV-2测试,包括快速抗原测试。
表5是指SARS-CoV-2 RNA的核酸扩增技术(NAT)测定。
表6和表7分别提到了对SARS-CoV-2抗原和抗体自检的额外要求。它们适用于已经经过专业使用的性能评估的器械。
表1 | 抗SARS-CoV-2的一线测定方法(包括快速测试):总抗体、仅IgG、IgG与IgM和/或IgA结合[1]
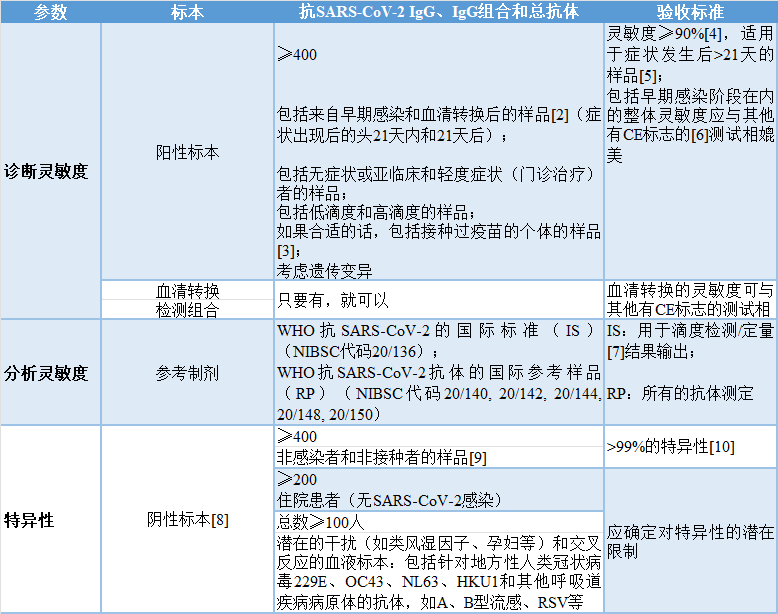
[1] 综合总体结果的性能声称;IgM和/或IgA的单独声称见下表。
[2] 应提供采样与症状发生(或感染时间,如果有的话)之间的详细时间间隔。
[3] 制造商应提供对疫苗接种者中相关抗体的灵敏度评价的适宜性和时间的说明。
[4] 基于确认的SARS-CoV-2-NAT阳性结果。
[5] 由于灵敏度可能随时间变化或降低,对灵敏度的要求应与症状发生后或在最初的PCR诊断时取样和测试之间的时间有关。
[6] 根据(欧盟)2017/746号条例,CE标志为D类。在过渡阶段,参考欧盟和ECDC SOTA指南和当前科学文献。
[7] 定量测定,如果它们也是一线测定。
[8] 阴性标本应来自没有SARS-CoV-2感染史的个体(如果在大流行前有)。
[9] 如果适当的话,可以包括用与各自测试中使用的抗原不同的抗原接种的个体。
[10] 假阳性结果应通过在其他SARS-CoV-2血清学测试中重新测试来解决,必要时采用与初始测试不同的测试设计和抗原涂层,和/或确认测试。
表2 | 抗SARS-CoV-2的测定(包括快速测试):IgM和/或IgA检测
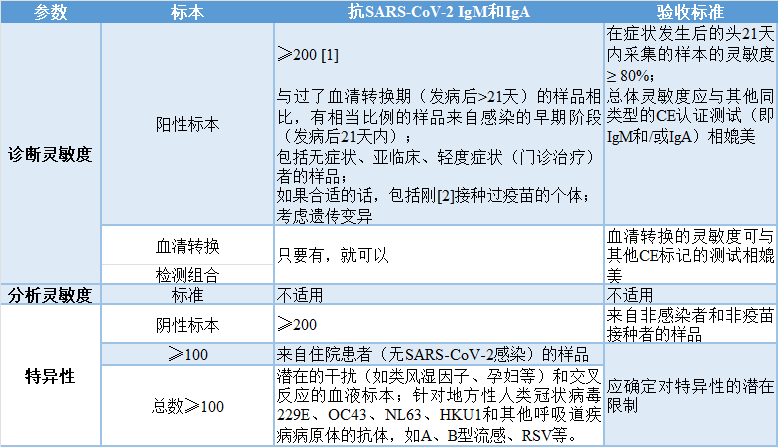
在适用情况下,应适用表1的脚注。
[1] 如果是组合测试,每个标志物IgM和IgA为200。
[2] 制造商应说明对疫苗接种者的IgM和IgA进行灵敏度评价的适宜性和时机。
[3] 对假阳性结果的澄清可另外包括测试是否存在其他抗SARS-CoV-2抗体类型(IgA、IgG、总抗体)。
表3 | 抗SARS-CoV-2的确认或补充[1]测定

[1] 例如:提供与初始抗体测试中使用的抗原不同的免疫印迹。
[2] 阴性标本应来自没有SARS-CoV-2感染史的人(如果在大流行前有)。
表4 | SARS-CoV-2的抗原测定(包括快速测试)
[1] 如果该器械打算用于一种以上的标本类型,则每种标本类型需有100个样品。如果在特殊情况下无法做到这一点(例如,如果标本采集的侵入性很强),制造商应提供理由和基质等效的证据。
[2] 取样应与抗原和NAT测试相匹配,例如,从每个人身上同时取两份样品,或最好从同一样品中进行NAT和抗原测试(例如,从一个拭子的洗脱液中);缓冲液/运输介质应与NAT和抗原测试兼容;用于样品吸收的缓冲液/介质任何体积变化与专有测定的不同,和/或在抗原和NAT测试之间应明确告知。
[3] 或感染时间,如果知道的话,考虑到孵化时间。
[4] 即不进行预选;应显示病毒载量及其分布,如通过RT-PCR的Ct-值来描述;或转化为每毫升或样品的病毒载量,如果适用。
[5] 取决于器械的设计和遗传变异的性质。为了评估的目的,每个基因变异体至少应代表3个样品。
[6] 标本采集和提取项目,如棉签、提取缓冲液等,应是评价的一部分。如果测试试剂盒中不包括专有的采样/样品制备,则应调查适用范围内的采样器械的测试性能。如果样品不是立即测试,例如在一定的运输时间后,应调查抗原的稳定性。
[7] 除快速测试外,即以实验室为基础的正式测定,如酶联免疫法、自动测试等。
[8] 分别为 ≥ 80%,≥ 85%的灵敏度,应是针对所有声称标本类型。所有声称标本类型应与鼻咽部标本的配对NAT结果进行比较。
[9] 应证明抗原测试性能与NAT之间的关系;可显示与不同病毒负荷范围和感染性阈值有关的灵敏度。
应描述所用的NAT和提取方法。
[10] 除非有可用的国际标准,否则可通过内部病毒制剂的稀释系列测试分析灵敏度,并与其他抗原测试和NAT进行比较;如果使用灭活病毒,应研究灭活和冷冻/解冻对抗原的影响。
[11] 例如,表达蛋白A或G的葡萄球菌和链球菌。
表5 | SARS-CoV-2 RNA的NAT测定

[1] 如果该器械打算用于一种以上的标本类型,每种标本类型需要100个样品。如果在特殊情况下无法做到这一点(例如,如果标本采集非常具有侵入性),制造商应提供理由和基质等效的证据。
[2] 制造商应在上市后的性能跟踪计划和报告中,根据更新的数据库条目确定定期监督检查的频率并记录证据。
表6 | 对SARS-CoV-2抗原自我测试的额外要求[1]
1] 假设自我测试的基本性能已经通过与被评估的自我测试相同设计的专业测试的评估/评价得到证明。如果有关的自用标本没有相应的专业测试变体,则应与相应的专业测试的标准标本类型(如抗原测试的鼻咽拭子,抗体测试的血清或血浆)进行比较。
[2] 对于器械声称的每种自用标本类型(如鼻腔、痰液、唾液、全血等)。
[3] 尽可能使用相应标本类型的原始自然基质。
[4] 较高比例的样品应在接近测试的截止点或LoD的弱阳性范围。
[5] 在自我测试前不知道专业诊断结果的个人,并执行从标本采集和标本预处理(拭子、缓冲液提取等)到读数的整个测试程序。
[6] 症状出现后7天左右的受试者。
表7 | SARS-CoV-2抗体自我测试的额外要求[1]
[1] 假设自我测试的基本性能已经通过与被评估的自我测试相同设计的专业测试的评估/评价得到证明。如果有关的自用标本没有相应的专业测试变体,则应与相应的专业测试的标准标本类型(如抗原测试的鼻咽拭子,抗体测试的血清或血浆)进行比较。
[2] 对于器械声称的每种自用标本类型(如鼻腔、痰液、唾液、全血等)。
[3] 尽可能使用相应标本类型的原始自然基质。
[4] 较高比例的样品应在接近测试的截止点或LoD的弱阳性范围。
[5] 个人在自我测试前不知道专业的诊断结果,并进行从标本采集和标本预处理(拭子、缓冲液提取等)到读取的整个测试过程。
本文中英文全文,点击下方链接获取~
链接:https://pan.baidu.com/s/13J90ZKcTa82UKAwF10j9eg
提取码:zj6c
诊断科学编辑团队收集、整理和编撰,如需更多资讯,请关注公众号诊断科学(DiagnosticsScience)。
来源: 诊断科学
声明:本平台注明来源的稿件均为转载,仅用于分享,不代表平台立场,如涉及版权等问题,请尽快联系我们,我们第一时间更正,谢谢!






