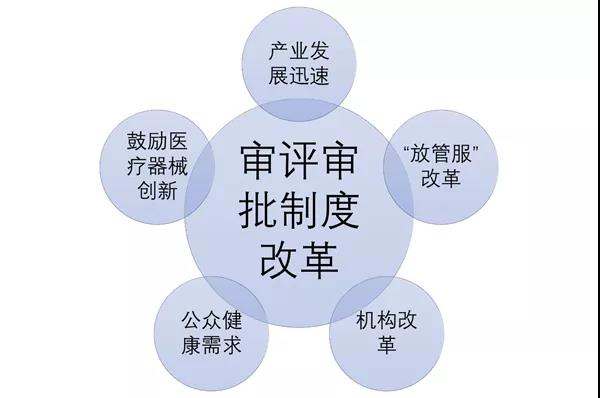
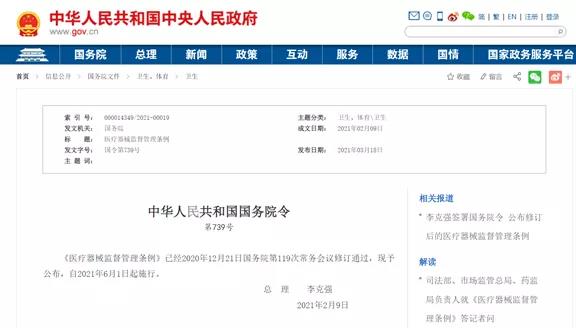
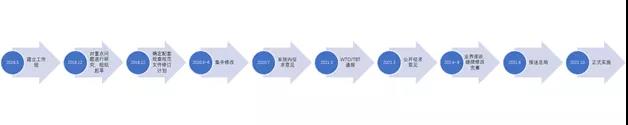
大家好,今天我们来和大家谈一谈《医疗器械注册与备案管理办法》的修订背景。办法本身已经于今年8月26日颁布,并且与10月1日起开始实施了,我们看到这个新办法的时候,很容易就会发现,这个办法的名称和之前有很大的不同,之前的办法名称是《医疗器械注册管理办法》,那么NMPA为什么要把这个名称改了呢? 这主要是NMPA希望能够更全面的反映,目前法规对医疗器械注册管理的有关内容。 其实在之前的旧版《医疗器械注册管理办法》当中,也包括了备案相关的内容,而这次把办法的标题进行修改,让其更能的全面反应办法的相关内容,而不是对办法所涉及的范围进行扩大,或者做一些原则性的调整。 本文将分成两大部分,第一部分是修订的背景和主要的过程,第二部分则包括主要的修订内容,其中包括法规的结构调整,内容调整和新增一些条款内容等等。 为什么要对医疗器械注册管理办法进行修订 1.1、对审评审批制度改革的需要 首先是关于修订的背景及过程,那么也就是说NMPA为什么要修订医疗器械注册管理办法?我们总结主要有三个大的方面的原因,第一方面就是国家对NMPA,也是NMPA自身改革的需要。 近年来党中央国务院对于医药产业的发展非常关注,那么也先后出台了一系列的重大的改革的这个意见,主要是2015年国务院发布的关于改革药品医疗器械审评审批制度的意见,也就是我们都熟知的44号文件。 到了2017年,两办发布了42号文件,即关于深化审评审批制度改革与药品医疗器械创新的意见,那么为了落实党中央国务院有关意见的要求,NMPA积极采取了落实措施,并且制定了相关的改革任务的分工表。 在42号文件中,国家明确了14项的重点任务和63项具体举措,这些相关的任务和举措都在逐一落实的过程当中,我们也看到近年来NMPA也先后发布了很多规范性文件,比如说对创新医疗器械特别审查程序进行了修订,对临床试验由审批制度改为默示许可,并且也发布了相应的通告,这些基础的改革成果,需要在法规的修订过程当中,进一步的得到落实和规范化。 这些规范性文件的落实和规范化,不是仅靠条例就可以的,因为条例毕竟是上位法,不可能,也没必要把所有的相关细节都写进去,这部分的任务呢,就落在对配套规章制度的修订上面,也就是说对像医疗器械注册管理办法这样的规章进行修订,在其中体现改革的成果。 同时,这几年,医疗器械产业发展十分迅速,特别是新冠疫情爆发,可以说引起了社会各界对医疗器械产业的关注。在以前,人民群众对医疗器械可能有一定的认识,但是并不是特别深,但是现在可能任何一个普通人可能都会清楚的说出在进行新冠病毒检测时,需要核酸检测试剂。 一叶知秋,从中我们可以看出,现在医疗器械行业的热度是非常高的,公众对于健康的需求也在不断提高,产业迎来了非常好的一个发展的机会,这些都是NMPA改革的压力和动力。 同时国家放管服的改革也在不断的推进,NMPA本身也在进行了机构改革,这些大的变化都需要我们的部门规章顺应形势,按照条例的要求去进行调整,这是改革的第一个原因。 1.2、医疗器械监督管理条例进行了修订 第二方面是一个最直接的原因,就是医疗器械条例进行了修订。 医疗器械监督管理条例于2020年12月21日,经国务院第119次会议修订通过,2021年2月9日李克强总理签发了这个条例,在2021年6月1号,新条例已经正式实施了。 NMPA也已经发布了关于贯彻实施医疗器械监督管理条例有关事项的公告,条例确定了风险管理、全程管控、科学监管、社会共治的这样一个医疗器械监督管理的一个基本的原则,那么提出了鼓励行业创新发展的明确要求。 在这个里面,比较重要的一条,就是注册人备案人制度作为一项基本制度也贯穿条例的始终。 同时条例还强化了对医疗器械全程管理,明确要加强监管能力建设,提高监管效率,特别是加大了惩处力度。那么这些都需要在医疗器械注册与备案管理办法里进行落实落实,所以说,这是办法修订的第二个,是一个最主要的原因。 1.3、解决旧版医疗器械注册管理办法中的问题 2014年,旧版医疗器械注册管理办法发布实施,在实施的这些年过程中,对于规范医疗器械注册管理,促进整个行业的健康快速的发展,应该起到了很好的作用。 但是在实施过程当中出现了一些问题,比如说在进行质量体系现场的时候,有些企业不向省局递交核查的资料,或者以种种原因拖延核查,导致产品已经申报,甚至已经完成技术审评后,体系核查工作还不能开展,项目还是不能进行关闭。 还有比如在开展临床试验监督抽查或者其他一些检查的时候,有些企业在检查前提出了自行撤回的申请,还有像强制性标准的如何执行的问题,这些细节的问题都需要通过管理办法进行修订,通过进一步细化操作,这样注册管理办法才加符合工作实际。 医疗器械注册与备案管理办法修订过程 在NMPA对医疗器械监督管理条例修订的同时,同步启动了医疗器械注册与备案管理办法的修订。从18年3月份开始,NMPA就开始着手准备相应办法的修订工作,并且成立了相关的工作组。 到了18年12月的时候,工作组对一些重点的问题进行了研究,并且组织起草了相关文件。 在19年12月,确定了条例全部配套的规章规范文件执行计划,并且在20年5~6月份进行集中的修改,7月份在系统内征求了意见。 在2021年3月份进行了WTO和TBT都进行通报,并且公开征求了意见。 2021年4~6月份的时候,NMPA也举行了相应业界座谈会,包括企业和省级监管人员,根据相应的意见,对条例进行了相应的修改完善,在6月份报送了市场监管总局,8月份获得批准通过,10月份正式执行。 这个是整个办法的一个修订过程,可以说整个修订过程和医疗器械监督管理条例是同步进行的,并且根据条例修订的情况不断的进行调整和完善。 比如在办法修订过程中,有一个大家最关心的统一审评审批的问题,在最开始的时候,规定是将所有的审评和审批权限都收归国家,但后来经过讨论和修订,还是维持目前国家级、省级和市级三级审评审批和备案的制度,在办法修订的过程当中,也进行了相应的同步修订工作。 医疗器械注册和备案管理办法的修订思路 医疗器械注册和备案管理办法的修订主要的思路可以总结为以下4点: ✔ 全面落实医疗器械注册人备案人制度,强化企业的主体责任; ✔ 鼓励创新发展,激发市场活力; ✔ 完善技术、程序要求,提高监管科学性,同时解决注册管理中面临的一些实际问题; ✔ 充实监管手段,严格注册管理。 这些修订思路都是按照条例的要求和国家对于医疗器械发展的一些具体要求进行了完善和细化。 好了,以上就是今天分享的全部内容,如果大家有什么疑问,欢迎在后台给我们留言,或者加入我们一起讨论~ 来源:诊断科学 作者:小潘老师
声明:本平台注明来源的稿件均为转载,仅用于分享,不代表平台立场,如涉及版权等问题,请尽快联系我们,我们第一时间更正,谢谢!






