大家好,从今天开始,我们来讲一下稳定性试验,稳定性是IVD试剂必须具有的基本属性,是确保产品在使用过程中安全有效的重要指标。
稳定性研究是根据产品的理化性质,设计合理的稳定性研究试验项目,以考察不同条件下产品的主要质量指标随时间的变化情况,为产品的保存多件和有效期的确定提供依据。
01 研究目的
IVD试剂生产商使用稳定性测试来确定其产品在规定的储存和处理条件下保持满足其预期用途的持续时间。
这个评估包括保存期和使用寿命:
保存期是直至失效期的时间段,此时间段内在制造商规定的储存条件下IVD试剂在其原始包装内保持其稳定性;
使用寿命是产品一旦投入使用而保持可用的时间段(例如,质控品开瓶后,试剂盒的校准间隔)。
产品稳定性的特点受多个内部和外部变量的影响,如组分、成品的容器系统、储存条件、复溶和操作流程。与其他性能指标(如精密度和真实性)不同,生产商的稳定性声明通常不由客户验证,除非通过日常质量控制(QC)结果的趋势过行的间接验证。
用于稳定性评估的IVD试剂是最终设计版本,且在终端用户包装或容器中是可用的,除非在风险评估中需要另一种配置,或者二次包装以保护产品不受外部影响,诸如湿度、光线、温度等物理因素。
例如,包装实际的密封纸箱,终端包装中装液体质控的螺帽管,以及用于装样品稀释液的密封瓶。
02 检测要求
测试稳定性的第一部分,要求生产商选择最有可能体现存储期间产品的质量、安全性和/或功效的潜在重要变化的指标。
这样的指标可以反映产品本身的物理、生物、化学和/或微生物特性或使用中产品的分析性能。
前者包括颜色、pH,粒径、标在的沉淀物、生物负荷、均一性和纯度。后者则包括被测量漂移、检测限、特定分析物浓度下的方法精密度、回收率,以及由干扰物质引人的偏倚。定量和定性IVD试剂的稳定性测试均需要选择合适的性能指标参数。
要测试指标的数量和性质取决于具体产品、产品的设计输人要求,以及类似产品的稳定性经验数据。例如,对于一个新的体外诊断试剂的保存期的评价(即实时稳定性评价),要3个批次;模拟运输,1个批次;等等。
没有必要在每个稳定性测试点评估所有指标,但至少在研究开始和结束时需对它们进行测试。
如果在整个研究持续时间内产品表现出比预期更多的降解,则需要加入中间点或其他中间时间的测试,这对于最初设计的长期研究来说尤其重要。随着对产品稳定性的了解,在随后的研究中可以减少或去掉这些中间测试点。
使用回归分析评估不同时间对应的指标变化也需要在中间点测试。虽然回归分析应用于被测量漂移指标,但是其也可以应用于其他定量特性指标,如回收率或干扰偏倚、粒径、含水量和杂质含量。
03 验收标准
产品稳定性是观察到的变化量和时间的函数。为了确定产品被认为是稳定的持续时间,在开始研究之前,必须确定每个稳定性指标的最大允许变化范围。
这些验收标准可能来自产品的设计输人要求,特别是其预期用途,或其他质量标准,类似产品的历史数据或现有产品的典型性能(用于产品设计变更的稳定性验证)。
大多数产品稳定性研究使用多个测试样品,以评估整个方法学分析测量范围内的性能。
在这些情况下,首先为评估每个样品独立的稳定时限,然后将最小稳定时限作为该批次产品的整体稳定期。根据包装标签的不同,校准品和质控品亦或每个水平具有独立的保存期,亦或采用试剂盒中所有水平的最小稳定时间。
04 稳定性研究设计的选择
最终稳定性结果的不确定性与生成这些结果的测量不确定性直接相关。一些不确定性可以通过方案设计来减少,这些方案设计用于从稳定性研究的测试存储条件放入和取出产品。
有两种基本的方案设计:经典的和同步的。每种方案都有不同的优势,以及相应的前提条件和风险,下文将对此进行介绍。
4.1、经典设计
经典的方案设计要求在研究开始时即将产品置于试验储存条件下,然后在研究过程中规定的时间点取出进行测试。
这种设计的优点是能够在给定的测试日得到结果,可以在制定的测试时间尽可能快地提供结果。
缺点是这种设计稳定性评估的结果不仅包含了由于样品稳定性、仪器硬件维护、更换或替换导致的偏倚或变异性,还掺人了测试过程长期的变异性。
此外还包括实验室环境波动,仪器通用试剂批次的变化,或跨越多个校准周期,以及在研究期间不同操作者的参与等。
4.2同步设计
另一种方法是同步设计,它可以以交错起始或交错结束模式来完成(图1)。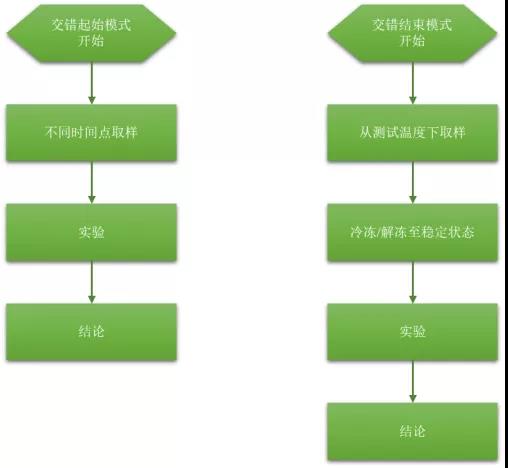
图1|交错起始、交错结束模式流程
同步交错结束设计类似于经典设计,即在研究开始时将产品放置在测试储存条件下,然后在整个研究期间规定时间点取样测试。
不同之处在于,当产品取出时,将其置于假定的稳定储存条件(如-70℃)直至研究结束。交错的起始模式仅颠倒了设计。从一开始就将产品保存在假定的稳定条件下,并且在不同时间点取出并放置于稳定性测试条件下。所有的产品在研究的最后一天同时进行测试。
同步设计的优势在于,所有的样品都可以在一个批次中进行测试,采用通用测试材料、仪器系统、操作员和条件随机进行检测,这可以显著减少稳定性评估的不确定性,消除在研究期间对仪器或实验室出现问题的担忧。
使用同步设计既有前提条件也有严重缺陷。
前提条件是产品必须能够经受至少一个冻结/解冻循环,或者可以找到稳定的储存条件来保存材料直到最后的测试日。
缺点是直到研究结束才能得到最终结果,早期无法发现产品不稳定。
这被认为是高风险的,特别对于新产品,建议用于衍生产品或者已知稳定性产品的稳定性监测研究。如果满足试剂可以冻结/解冻前提条件,同步设计也可用于短期研究,如校准周期,质控品的使用寿命或加速试验。
05 研究依据
如果实验性方案提供了所需的统计置信度和功效,测试稳定性指标的结果可得出有效判断。需要适当的平行测试,由此每个测试都有足够的功效检测到重大的变化,并有足够的置信度去确认何时没有发生重大变化。
统计学家的协助可能有助于确保稳定性指标的实验方案能提供必要的统计置信度和功效。本部分使用单侧95%置信区间,被测量漂移作为定量IVD试剂稳定性评估的依据。如果适当的话,通过使用97.5%或99%的置信区间可以实现更保守的稳定性评估。
好了,以上就是今天分享的全部内容,如果大家有什么疑问,欢迎在后台给我们留言,或者加入我们一起讨论~
责编:安悦
信息来源:诊断科学
声明:本平台注明来源的稿件均为转载,仅用于分享,不代表平台立场,如涉及版权等问题,请尽快联系我们,我们第一时间更正,谢谢!






