文章来源:合成生物学
刘奇奇, 王春玉, 齐天翊, 朱明盛, 黄兴禄
5月10日,国家发展改革委印发《“十四五”生物经济发展规划》(下称“《规划》”)。文件提出,推动合成生物学技术创新,突破生物制造菌种计算设计、高通量筛选、高效表达、精准调控等关键技术,有序推动在新药开发、疾病治疗、农业生产、物质合成、环境保护、能源供应和新材料开发等领域应用。
合成生物学是什么?
广义上,合成生物学是指通过构建生物功能元件、装置和系统,对细胞或生命体进行遗传学设计、改造,使其拥有满足人类需求的生物功能,甚至创造新的生物系统。目前,合成生物学落地的主要场景为改造微生物,以生产具有高附加值、通过传统方法化学生产成本较高、碳排放较大或难以大量获得的产品。
合成生物应用场景丰富,涵盖医疗健康、化工、农业、食品、消费品等;同时,行业技术不断推进,在DNA合成、组装及基因编辑技术进步下,行业通量和成本大幅改善。中信证券预计,2020-2025年,全球合成生物市场规模将保持22.5%的高年均复合增速,至2025年有望突破200亿美元。
随着合成生物学的兴起,如何对生物体进行理性设计、改造乃至从头合成,成为这一领域的研究热点。目前,科学家已经能够对核酸、蛋白质、脂质、酶等生物基大分子进行设计和合成。酶作为其中重要的一部分,是维持生物体正常生命活动所不可缺少的。
天然酶具有极强的催化能力,能在常温常压下将化学反应的速度提高107~109倍,因此具有广泛的应用价值,预计到2024年全球酶市场将达到105亿美元[1]。随着人们对其需求越来越大,天然酶在来源、提取、保存、使用等方面的诸多弊端也被暴露出来。
为应对以上问题,人工酶(artificial enzyme)的研究被提上日程,也是酶学研究中一个重要里程碑。通常,研究人员可以寻找并模拟大自然的智慧,通过计算[2]和直接进化[1]的方式进行人工酶的设计和构建;或者,研究人员也可以通过研究酶的物理化学内在相互作用,使用合成材料来构建人工酶[3]。
作为一种新型人工酶,目前纳米酶的研究基本上还是属于材料领域的延伸,严格意义上与合成生物学的内容相差甚远。最近,研究者以基因重组的重链铁蛋白作为蛋白骨架,通过仿生、创造等理念,在其内腔中合成了一系列的纳米酶新材料,从而融合蛋白骨架的靶向和纳米酶的催化等性能于一体。鉴于这种策略实现了合成生物学、纳米酶催化和纳米生物学等技术的深度融合,在此研究者将其命名为“合成生物纳米酶”。
本文将从纳米酶的基本概况、天然蛋白骨架纳米酶、基因改造蛋白骨架及合成生物纳米酶4个部分展开综述。
1 纳米酶的基本概况
纳米酶(nanozyme)是一类本身蕴含酶学特性的纳米材料,能够催化酶的底物,产生同天然酶类似的催化反应,并具有酶促反应动力学等特征,属于一类新型模拟酶[4-5]。与天然酶类似,纳米酶可以在温和的生理条件下高效催化酶的底物,因其可调的催化活性、苛刻条件下的高稳定性、组成和结构设计的灵活性以及优异的生物相容性等优势,成为了天然酶的理想替代品[6-7]。2007年,阎锡蕴院士团队[8]首次报道并证明了磁性四氧化三铁纳米颗粒的类过氧化物酶活性。随着近年来纳米技术、合成生物技术、催化和理论计算的飞速发展,越来越多具有不同类酶活性的纳米酶被发现或设计,纳米酶的优势也逐渐被挖掘出来(表1)。
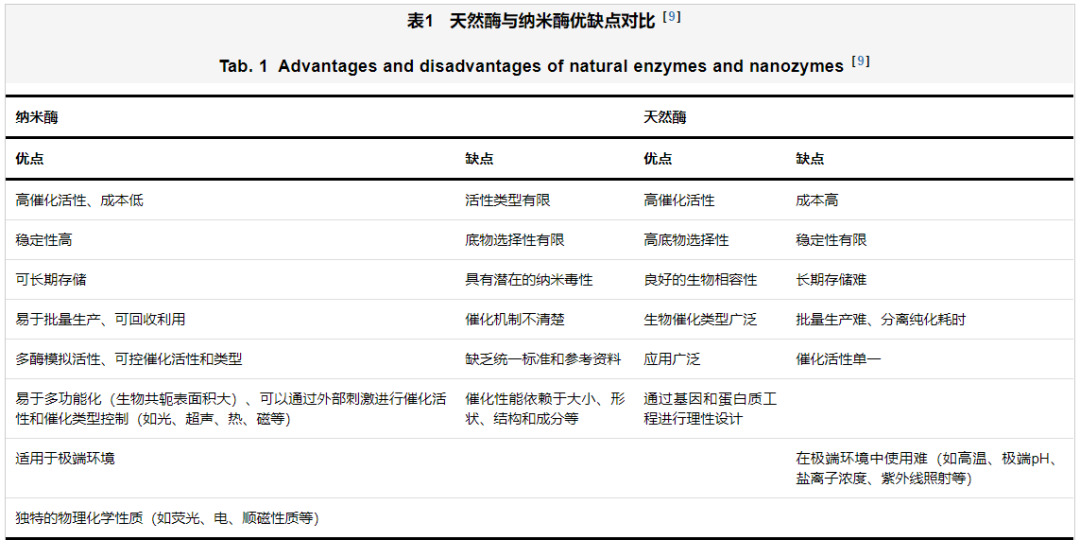
合成的纳米酶可以模拟天然酶的结构或功能,能够催化与酶相同的底物和化学反应,主要模拟的酶类型有氧化还原酶和水解酶等,有些纳米酶可同时表现出双酶或多酶活性,这些活性被广泛应用于生物传感、生物成像、抗菌、抗氧化、疾病诊断治疗等领域[10]。
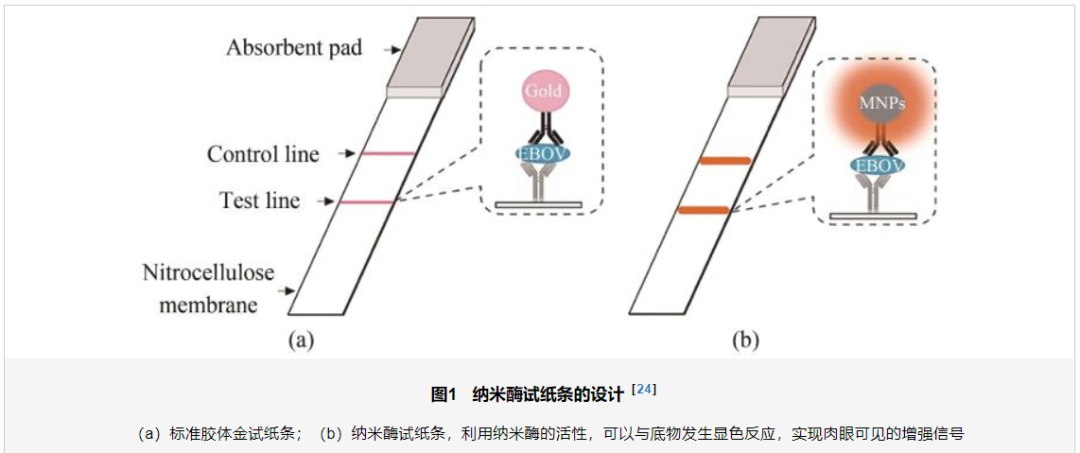
近年来,纳米酶代替天然酶在开发免疫传感器中显示出低成本、稳定性好、灵敏度高和选择性强的优点。过氧化物酶样纳米酶用于构建多功能生物传感器[20-22]已被广泛研究。例如,Wei等[23]通过将葡萄糖氧化酶与具有类过氧化物酶活性(peroxidase,POD)的Fe3O4纳米酶结合,开发了一种兼具敏感性和选择性的葡萄糖传感策略。纳米酶制备的纳米探针还可以快速灵敏地检测病毒,Duan等[24]通过将Fe3O4纳米颗粒作为探针,开发了基于Fe3O4纳米酶的免疫试纸条(nanozyme-strip),可检测低至1 ng/mL的埃博拉病毒糖蛋白,将埃博拉病毒检测的精度提高了近百倍,检测的敏感性与ELISA方法相当,但是速度要快得多,可在30 min内完成且更为简单,这为埃博拉病毒疫情的诊断提供了便捷有效的筛查工具(图1)。
此外,纳米酶对活性氧(reactive oxygen species,ROS)的调控能力使其具有抗肿瘤[25]、抗氧化[26]和抗菌[27]等治疗潜力。以抗肿瘤治疗为例,纳米酶首先可以通过被动方式和主动方式靶向肿瘤细胞,然后利用类氧化物酶(oxidase,OXD)和POD活性直接生成或协同增强ROS来杀伤肿瘤细胞;或者通过其过氧化氢酶(catalase,CAT)活性,将肿瘤微环境的H2O2催化生成O2,可以有效缓解肿瘤组织乏氧,促进肿瘤细胞凋亡,也可以提高光动力、声动力和放射治疗等需氧治疗方法的效率。Fan等[28]利用氮掺杂多孔碳纳米球开发了一种具有4种类酶活性(OXD、POD、CAT和SOD)的纳米酶。在酸性条件下,碳氮纳米酶可以通过OXD和POD活性催化氧和过氧化氢生成活性氧自由基杀伤肿瘤细胞,在中性环境中,它们会发挥CAT和超氧化物歧化酶(superoxide dismutase,SOD)活性,能够清除自由基保护正常细胞不受损害。
纳米酶可以有效减轻氧化应激引起的损伤,即抗氧化作用。例如,ROS可能是脑型疟疾发生过程中损害血脑屏障的重要介质,Zhao等[29]针对脑内皮细胞中ROS上升的特点,设计合成了铁蛋白纳米酶,其在中性条件下具有的CAT活性可以保护血脑屏障内皮细胞免受ROS损伤,显著提高了实验性恶性脑疟小鼠的存活率。同时铁蛋白纳米酶和抗疟疾药物蒿甲醚联合给药时可以显著减轻恶性脑疟小鼠脑部炎症和记忆障碍。纳米技术在抗菌、抗病毒方面也展示了巨大的应用潜力[27]。目前,抗菌纳米酶主要包括金属基化合物、碳基纳米材料、过渡金属硫化物/过氧化物/氧化物、单原子纳米酶和金属有机框架(metal-organic frameworks,MOFs)基化合物等[27, 30-33]。例如,石墨烯量子点(GQDs)是一种具有类POD活性的碳纳米材料,GQDs催化过氧化氢分解生成具有较高抗菌活性的羟基自由基,以达到杀灭细菌的作用,对大肠杆菌等革兰氏阴性菌和金黄色葡萄球菌等革兰氏阳性菌均具有广泛的抑菌活性[33]。
2 天然蛋白骨架纳米酶
基于天然蛋白为骨架设计的纳米酶,通常以天然蛋白质为载体,与纳米酶共同组成复合材料。该系统具有如下优势:
(1)良好的生物相容性:天然蛋白骨架大多为内源性物质,具有低毒和低免疫原性,并且代谢产物安全。
(2)较强的稳定性:天然蛋白通常在一定的温度和酸碱度下保持结构稳定,对于一些如金属纳米团簇/颗粒材料等不稳定的纳米酶,天然蛋白骨架可以通过与其结合或包载提高整体稳定性。
(3)出色的靶向能力:许多天然蛋白可以通过与某些细胞表面受体天然的亲和力实现靶向递送。
(4)可延长体内半衰期:一些天然蛋白可以通过躲避免疫系统的识别和清除(如血清白蛋白等),延长自身在循环系统中存在的时间。
天然蛋白骨架原位合成或包载纳米酶通常利用了蛋白配体和金属之间存在的相互作用,这种相互作用主要与金属携带的正电荷有关,同时蛋白质的局部电荷和构象特征也会影响金属结合位点的活性高低[34]。蛋白质与金属配位主要依靠的是侧链残基上能够提供电子的氨基酸。例如,存在于螺旋或β链中的组氨酸通过咪唑环上氮提供的孤对电子与金属元素配位[35];存在于螺旋、转角和环中的天冬氨酸和谷氨酸通过羧酸基团与金属元素结合[36]。主链上的羰基氧也参与一些金属元素的结合,尤其是Ca(Ⅱ)[37]。
白蛋白是血液中最为丰富(35~50 g/L人血清)的血浆蛋白。作为一种内源性的蛋白,白蛋白无免疫原性,由肝脏合成,主要用于维持血浆pH和渗透压[38]。白蛋白具有半衰期长、水溶性好的特点,在人血液中的半衰期约为19 d,以此合成纳米酶可保持纳米酶相对较长时间不被清除,使得纳米酶能够更持久地发挥活性。目前对于白蛋白金属结合位点的研究已经比较清晰,大多数的哺乳动物白蛋白主要包含4个金属结合位点[39],分别是位于N末端的结合位点(N-terminal site,NTS)、Cys34及其附近的环境、位于界面处的多金属结合位点A(multi-metal binding site,MBS)和位置暂时未知的金属结合位点B,这4个金属结合位点在蛋白结构和金属离子结合特异性上存在较大的差异。
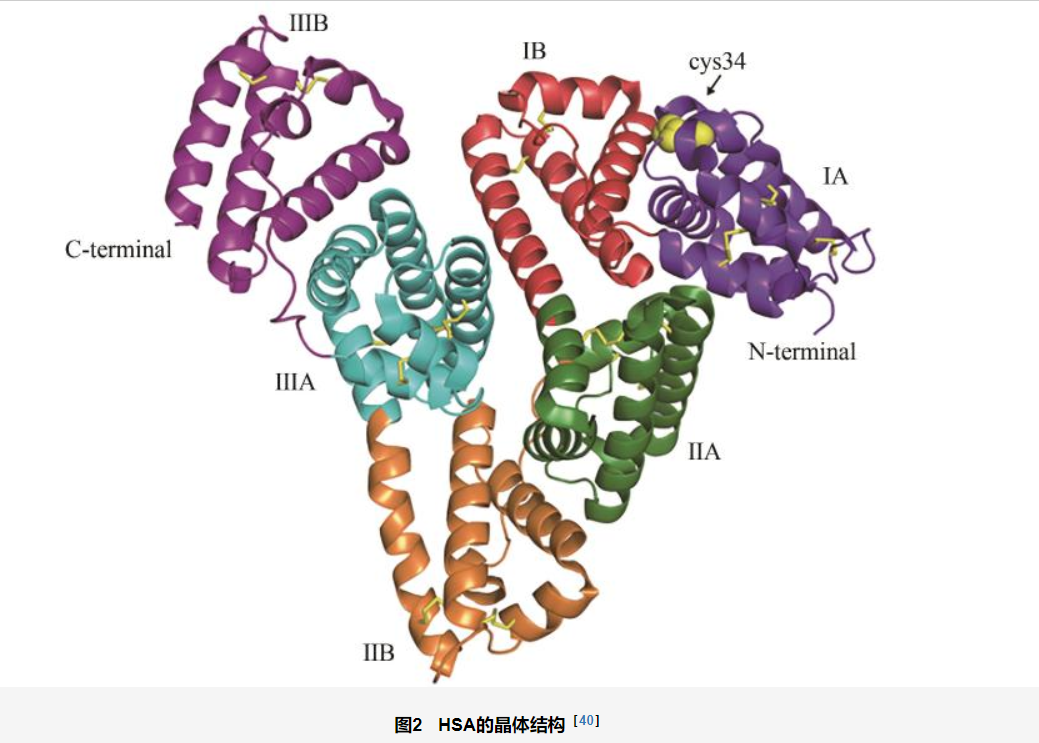
人血清白蛋白(human serum albumin,HSA)和牛血清白蛋白(bovine serum albumin,BSA)是最为常见的两种白蛋白类纳米酶骨架。其中,HSA的整体三维结构呈心形,由3个同源结构域Ⅰ、Ⅱ和Ⅲ组成,每个结构域包含两个亚结构域(A和B)[40](图2)。目前研究表明,HSA中存在多个配体结合位点,能通过共价或非共价的结合方式实现药物或金属等物质的搭载,因此是与纳米酶结合的理想载体。HSA还具有天然的肿瘤组织靶向能力,主要是基于其与细胞表面受体(包括gp18、gp30、gp60、FcRn)之间的相互作用[41]。BSA在结构和理化性质上与HSA有相似性,也可作为纳米酶的天然蛋白骨架。Huang等[42]利用HSA修饰四氧化三锰(Mn3O4)纳米颗粒,发展了一种新型复合抗氧化纳米材料来抑制缺血性中风再灌注引起的神经系统损伤。其中,HSA的修饰使得该纳米酶复合材料表现出很好的生物相容性和较低的器官毒性等特征,能够治疗小鼠缺血性脑卒中再灌注引起的脑损伤。Han等[43]以BSA为模板实现了二氧化锰纳米片的可控合成,通过改变BSA的浓度能够影响纳米酶材料的类酶活性。此外,该纳米材料还具有串联酶催化的特性,从而利用此特性提出了一锅法、无酶葡萄糖比色传感新策略,该方法灵敏度高、检测限低、检测时间短,解决了传统血糖检测方法中生物酶、多催化剂、分步反应、非原位反应带来的问题。
丝蛋白(silk fibroin,SF)也是一种广泛应用于纳米递送系统的天然蛋白。丝素蛋白纤维核心由1个重链(约350 kDa)和1个轻链(约25 kDa)组成,通过二硫键和糖蛋白连接在一起。重链丝蛋白的一级结构中具有(Gly-Ser-Gly-Ala-Gly-Ala) n 的氨基酸重复序列[44]。丝蛋白具有优异的生物相容性、可控的生物降解性和低免疫原性,还能通过与其他聚合物混合来调节其性能,可显著改善纳米酶的生物利用度。Yang等[45]在丝蛋白存在的条件下,利用氯金酸和氯铂酸的生物结晶(bioinspired crystallization)构建了Au、Pt双金属纳米酶,并在体外4T1肿瘤细胞和体内异种移植肿瘤模型上证明了所合成的AuPt@SF(APS)纳米酶的抗肿瘤作用,这些纳米催化剂对肿瘤微环境特别敏感,可实现有效的肿瘤治疗和诊断。
天然酶自身也可以作为一种纳米酶合成蛋白骨架,从而可以产生更为丰富的催化能力[46]。Zeng等[47]将金纳米颗粒(Au)与辣根过氧化物酶(HRP)相结合,组装成纳米催化共轭物(HRP-Au)进行葡萄糖检测,HRP/Au的适当混合可以显著提高级联反应的催化活性。Losada-Garcia等[48]使用几种酶分子为蛋白骨架合成了铜纳米颗粒杂化的铜纳米酶,杂化后的纳米酶具有不同于酶支架的酶活性,并且铜纳米颗粒和支架酶之间的协同作用还可以提高杂化铜纳米酶的氧化还原酶活性。Li等[49]将脂肪酶-聚合物共轭物与Pd纳米簇杂化构建了脂肪酶-Pd纳米簇杂化催化剂,在催化S-1-苯乙胺外消旋中表现出了较商用Pd/C催化剂高50倍以上的活性,并且还可以回收重复使用。
3 基因改造蛋白骨架
天然蛋白骨架在合成纳米酶上最大的问题是可塑造性差,以基因重组、改造为基础的可设计蛋白骨架,其最大的特点是可“按需定制”,能够赋予蛋白骨架更多的功能,如靶向疾病等。在纳米研究领域,可设计蛋白骨架最具代表性的是蛋白纳米笼。与传统纳米材料相比,蛋白纳米笼因其高比表面积、内/外表面可设计性、多功能性和特殊的内在特性,在包括药物输送在内的多个领域中具有良好的应用前景[50-52]。以这种蛋白纳米笼为蛋白骨架,仿生合成纳米颗粒为进一步开发纳米酶材料提供了基础。
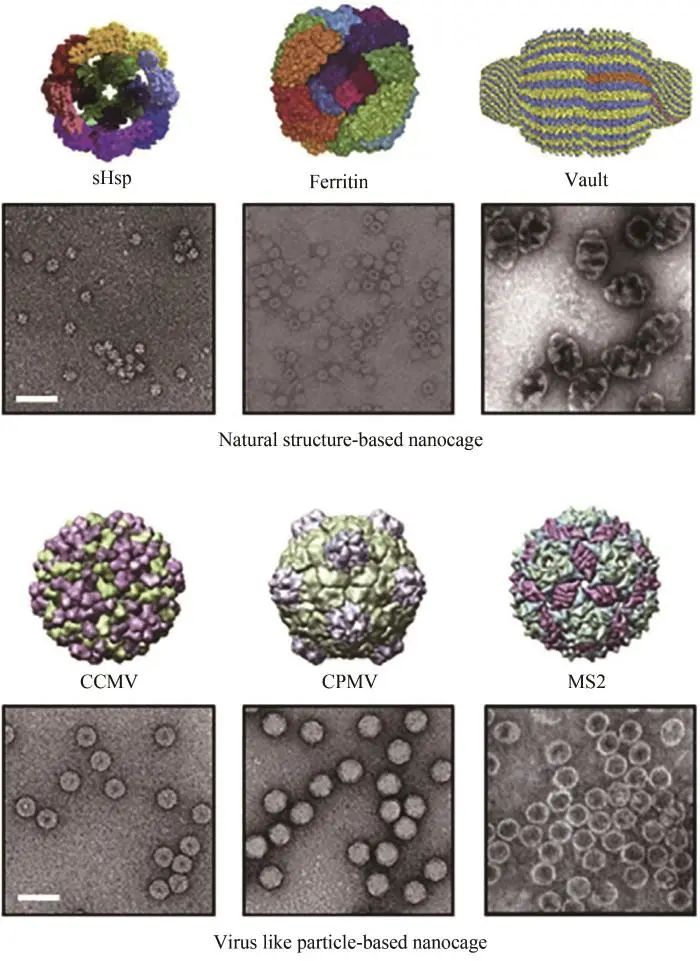
自然界中存在很多种天然自组装的蛋白纳米笼结构,如铁蛋白、小热休克蛋白(sHSP)[53]、封装蛋白[54]和lumazine合酶[55]等;此外,病毒样颗粒(virus-like particles,VLP)也是一种自组装纳米颗粒,包括豇豆褪绿斑驳病毒(CCMV)、噬菌体P22等[52](图3)。一些笼状蛋白本身就是一种酶,肺炎链球菌的氨基肽酶是一种锌依赖的金属肽酶,由12个亚基自组装成四面体,在其中合成Pt金属纳米颗粒,能够将铂催化加氢和肽酶水解多步催化反应结合在一起[56]。
天然笼状蛋白也可以通过基因重组、改造得到,使其“按需”获得一定的功能。此外,它们也可作为蛋白骨架,仿生合成各种金属纳米材料。天然铁蛋白(ferritin)由重链和轻链亚基组成,基因重组重链铁蛋白是由24个亚基自组装成的中空笼状结构(ferritin nanocage,FTn),外径和内径分别为12 nm和8 nm。FTn能够结合肿瘤高表达的转铁蛋白受体1(TfR1)[57-58],具有肿瘤靶向的特性及穿越血脑屏障的能力[59],已在肿瘤靶向治疗[60-61]及成像[62-63]等领域被广泛应用。FTn可以方便地通过遗传或者化学的手段在内腔、外表面及亚基界面修饰改性来获得新的功能,如在表面引入RGD基序[64]及表皮生长因子(EGF)[65]等来改善靶向或治疗能力。重要的是,FTn自身具有生物矿化特性,可以作为蛋白骨架在其内腔原位合成金属纳米颗粒,包括Fe、Pt、Pd、Cu、Co、Au、Ag等[66-67]。进一步通过基因工程改造内腔,可提高合成金属纳米颗粒的合成效率,如在内腔引入半胱氨酸和组氨酸,可以通过巯基/咪唑和一些金属螯合,增加铁蛋白内部的金属装载量[68]。除了铁蛋白外,一些其他基因改造的笼状蛋白也被用于合成纳米颗粒。将青蛙M-铁蛋白模拟肽(QEHEDE)或带负电荷的富含谷氨酸肽(EEEEEE)通过基因改造嵌入到内腔,可以使工程E2蛋白获得铁矿化的能力[69]。豇豆褪绿斑驳病毒(CCMV)由于具有较大且带正电的内腔,可被用于合成金属纳米颗粒,通过基因改造可以实现病毒衣壳内部的电荷转换,将其N端带正电的氨基酸替换为带负电荷的谷氨酸仍能保持其笼状结构,可以介导Fe(Ⅱ)在内腔的结合及24 nm的γ-FeOOH纳米粒子在CCMV内腔中的合成[70]。Giessen等[71]改造了T. maritima衣壳蛋白,在天然EncTm操纵子中删除了Flp,并在N端遗传融合了DNA编码的银沉淀肽AG4(NPSSLFRYLPSD),构了工程衣壳蛋白EncTmAG4,使其具有了内部形成银纳米颗粒能力。
天然蛋白经过亿万年进化,已形成了稳定的结构,因此,一定程度上基因改造的天然蛋白质还是能够维持其结构稳定性。与之相比,人为创造非自然界存在的蛋白骨架更具挑战,即利用算法语言进行计算编程、建模和模拟,从而从头设计蛋白质纳米笼。华盛顿大学Baker实验室[72]使用Rosetta套件高通量筛选的方式,将所有可能的界面趋近于自然进化的结构。之后通过软件对接最佳亚基和寻找互补性优化产物,在一项工作中设计出了5个笼状结构,每个结构由24个亚基组成[73]。除此之外,他们还进一步设计了蛋白纳米笼的外表面,通过螺旋间隔结构域将抗体的恒定结构域与纳米笼的外表面结合,这种方法可将抗体精准地结合到具有几何形状的纳米笼中[74]。Gao等[75]从头设计构建了一种氧气通透性可调控的人工蛋白纳米笼,策略是基于高分辨结构信息,利用亲和性的分子补丁封闭蛋白纳米笼外壳的通道,进而可逆地控制蛋白笼的氧通透性。这种从头设计策略对将来的纳米酶理性设计十分具有借鉴意义,或许可以成为纳米酶催化底物选择特异性及活性控制等策略之一。
一般来说,笼状蛋白可以在外腔、内腔和亚基界面基因工程化改造[76],如改造外表面使其具有靶向作用或改善其生物相互作用[77];改造内腔可以高效地装载或合成金属纳米颗粒[68, 78];改造亚基界面会使笼通道打开或诱导拆卸/重新组装[79-80]。这种以基因改造为基础的可设计蛋白纳米笼,在合成酶学的研究中可作为一个人工酶展示平台,用于展示具有精确空间关系的酶或构建多酶级联纳米反应器系统[81]。这些结构可以有效地模仿自然界中的酶络合物,通过酶的级联反应来提高催化的效率[82]。可设计蛋白纳米笼在纳米酶的研究中也可作为合成模板或生物反应器,以构建多样化和功能化的纳米酶[83]。因此,这样的特点可以将蛋白骨架的可设计优势与纳米酶催化特性巧妙地融合在一起,赋予纳米酶设计更多的可能性。
4 合成生物纳米酶
合成生物纳米酶是在上述基因改造蛋白骨架的基础上,利用和借鉴合成生物学技术手段和思路,开辟纳米酶研究领域的新分支。从设计上讲,区别于通常意义的纳米酶,合成生物纳米酶在结构上着重以基因重组、改造为基础的蛋白为骨架,再加以具有类酶催化活性金属纳米颗粒的合成,可以视其为生物材料和无机金属材料组成的杂化分子。合成生物纳米酶优于其他纳米酶的方面在于,研究人员可以将种种功能和结构部分作为一个模块/基块进行自下而上地组装和构建,这种构建方式以基因工程重组为前提,能够更为理性和标准化地控制。从催化机理上来讲,合成生物纳米酶的组成更类似于天然酶的组成特点,例如金属蛋白酶,因此也更容易模拟天然酶的设计,更容易探究其催化机理。从功能和应用上来讲,既可以利用蛋白骨架本身的功能,如靶向疾病等,也可以利用纳米颗粒的催化功能,两者合二为一。
基于以上特点,这种合成生物纳米酶目前研究最多的是铁蛋白纳米酶,我们和其他研究者在这方面做了许多的工作。基因重组重链铁蛋白(FTn)已被证明是一种优良的纳米递送平台[84],它可以穿越多种生物屏障[59],具有肿瘤靶向且可以趋向于低氧的肿瘤组织[85-86]。通过在铁蛋白内部仿生合成金属纳米酶,可以进行多种酶活性的模拟[83]。利用此种策略合成的人工纳米酶具有优良的单分散性、均匀的尺度及良好的生物相容性等优点。我们利用这种铁蛋白作为蛋白骨架原位合成制备一系列功能各异的纳米酶,如合成模块化组装铁蛋白Pt纳米酶具有肿瘤靶向杀伤能力[87];靶向改造的铁蛋白Mn纳米酶具有SOD-CAT级联催化活性[88];铁蛋白Pd纳米酶模拟细胞色素P450可实现生物正交催化[89];铁蛋白Fe纳米酶的过氧化物酶活性模拟胞内氧化应激[90]等。
氧化还原酶类的纳米酶可以进行ROS调控,进而进行细胞内重要功能的调控[91-93]。在FTn内部合成的Mn纳米酶具有类过氧化氢酶样活性。这种仿生人工酶可以有效穿透肿瘤组织缺氧区域发挥过氧化氢酶活性以提供氧气,这可以显著缓解肿瘤的缺氧。这种氧气的产生可以缓和光动力疗法对氧气的需求大、肿瘤部位氧气不足的问题,增强光动力疗法的疗效[94]。通过对铁蛋白外壳进行改造之后在其内部合成纳米酶,制备了靶向线粒体的铁蛋白纳米酶(mito-fenozyme),这种人工级联纳米酶具有类超氧化物歧化酶和过氧化氢酶样活性,可以克服多种生物屏障靶向线粒体。在心脏缺血再灌注损伤过程中,线粒体呼吸链中超氧阴离子的产生是造成再灌注损伤的重要因素[95],mito-fenozyme在线粒体部位发挥超氧化物歧化酶的活性,清除过量产生的超氧化物自由基,保护因缺血造成的组织损伤[88](图4)。
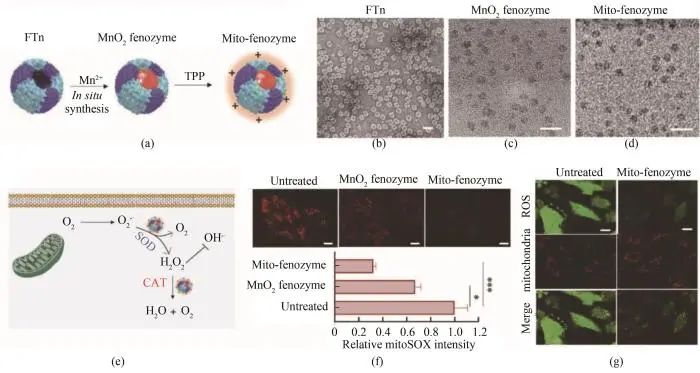
铁蛋白纳米酶因其出色的酶活性及可编程的特异性,在体外检测中也有出色的表现。最为经典的例子是铁蛋白四氧化三铁纳米酶,其具有过氧化物酶活性和TfR1结合能力,能够靶向肿瘤高表达的TfR1发挥活性,作者检查了来自9种癌症患者的474个临床样本,验证了此纳米酶可以区分癌细胞和正常细胞,灵敏度为98%,特异性为95%[96]。Jiang等[97]报道了通过将肝靶向肽SP94遗传融合到铁蛋白表面的方式,制备了遗传改造的肝细胞癌特异性靶向铁蛋白(HccFn),并在其内部仿生合成了钴纳米酶——HccFn(Co3O4)。这种遗传改造的人工纳米酶具有过氧化物酶样活性催化底物二偶氮氨基苯(DAB)的氧化,在H2O2的存在下发生颜色反应。作者检查了424份临床肝细胞癌标本,证实HccFn(Co3O4)纳米酶区分肝癌组织与正常肝组织的敏感性为63.5%,特异性为79.1%,与临床使用的HCC特异性标志物α胎蛋白相当。
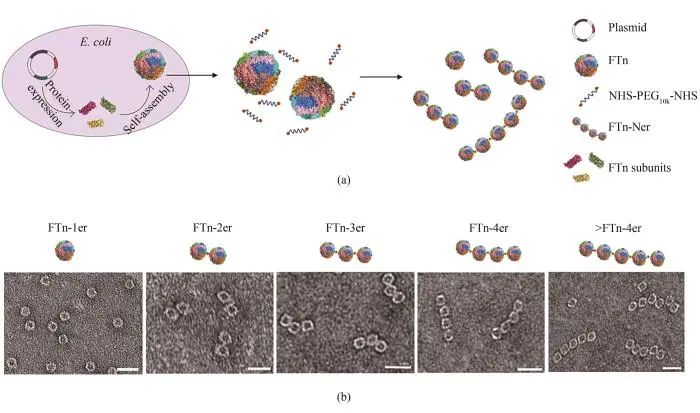
合成生物学模块化思路也可以应用于纳米酶的设计和构筑。通过对铁蛋白外壳组装后再组装的策略,制备了具有精确超分子结构的寡聚纳米酶[87](图5)。这种“自下而上”方式构建的寡聚纳米酶具有精确的结合价,有助于增加靶向、延长血液循环时间及肿瘤组织的穿透能力。寡聚铁蛋白铂纳米酶具有强的过氧化物酶活性,在溶酶体中产生高毒性的羟基自由基,最终导致肿瘤细胞死亡。细胞色素P450是一种末端加氧酶,参与了体内重要的生物学过程[98]。肝脏中的细胞色素P450是药物代谢的关键酶,可以将一些疏水药物转化为亲水以便于排除体外。最近研究发现,铁蛋白钯纳米酶(FTn-Pd)具有模拟P450BM3活性[89],可以特异性地切割丙基醚基团,并且可以在溶酶体中催化生物正交反应。在溶酶体内的酸性环境下,FTn-Pd纳米酶还会发挥其过氧化物酶活性,进一步介导溶酶体膜的渗漏。FTn-Pd纳米酶的多酶协同特性允许我们在溶酶体生物正交释药并克服溶酶体屏障增强药效。
5 展望
综上所述,纳米酶是一个学科交叉研究的产物,作为一个“载体”或“平台”,能够将多种不同的领域融合在一起,展现出强大的生命力。作为一种新型的人工酶,纳米酶能够把传统的酶类从“单分子”延伸至“颗粒”,极大扩充了合成生物学的工具包。纳米酶领域经过10多年的发展,目前已开发出成百上千种不同的纳米酶材料,能够模拟多种不同的酶活性,尤其是氧化还原酶类和水解酶类。基于这些酶的模拟,近年来,纳米酶在体外检测、体内疾病调控等方面正在发挥越来越大的作用,甚至在人造细胞的全合成方面也展现出一定的优势。然而,目前纳米酶领域仍然有很多问题亟待解决,如催化机制理论体系的建立、对底物选择性、类酶活性、标准化方法的建立等。为应对以上问题,借鉴天然酶的基本结构,即蛋白骨架和活性中心,理性设计所需纳米酶,使其结构更为简单、组分更为明确,将对解决目前纳米酶存在的基本问题提供很好的思路。
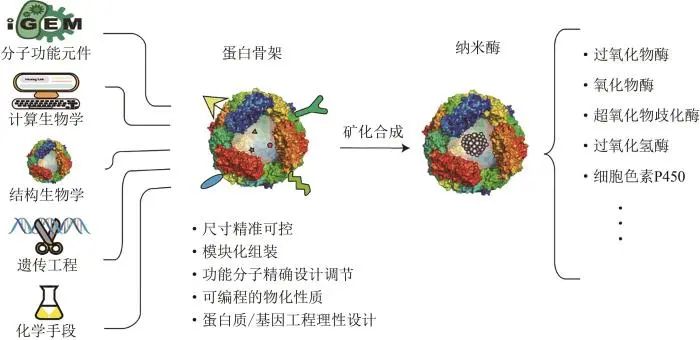
由于一些天然来源的蛋白容易获取,像HSA和BSA等,已被用来合成一些纳米酶材料,但这类材料仅仅利用了蛋白作为模板来合成材料,在材料的可控性、功能性和赋能性上大大受限。事实上,利用合成生物学理念和技术,通过基因工程改造或从头设计,一些非天然蛋白骨架已被越来越多地开发出来,这些蛋白骨架利用计算生物学、结构生物学、遗传工程、化学手段等将分子功能元件融为一体,使得获得的蛋白骨架具有多种优势,如尺寸精准可控、模块化组装、功能分子精准设计、性能按需设计等,这为进一步构建合成生物纳米酶提供了基础。某些氨基酸/蛋白结构域能够亲和/捕捉金属离子,从而为纳米酶材料的原位生长或矿化提供了结合位点,事实上,通过前期的基因改造或蛋白结构设计,也能够对结合位点或亲和金属类型进行按需定制,因此,相较于其他纳米酶,合成生物纳米酶允许我们集合人工筛选的或自然界中已有的功能模块进行重新整合,还可以将现有的计算生物学、结构生物学、蛋白/基因工程手段及化学手段等融为一体(图6),进行更为精巧设计和活性定制,这是优于传统纳米酶的一大特点。另外,以金属蛋白酶为例,经过亿万年的进化,酶的结构和表现的催化特性在某种意义上是一种极致的存在形式,蛋白的柔性和金属催化活性中心的完美协同作用,使其成为控制生命体代谢过程中不可分割的一部分。合成生物纳米酶以蛋白骨架原位合成纳米酶材料,其存在的必要性和优势也需要进一步挖掘和拓展,这也为传统酶学研究领域、合成生物学领域及其他新兴交叉领域展示了无限的可能性和新的思考。
参考文献 View Option
[1]Artificial enzymes bringing together computational design and directed evolution
[2]Computational enzyme design: transitioning from catalytic proteins to enzymes
[3]Artificial enzymes
[4]纳米酶标准术语
[5]Nanozymes: a clear definition with fuzzy edges
[6]Nanomaterials with enzyme-like characteristics (nanozymes): next-generation artificial enzymes
[7]Nanomaterials with enzyme-like characteristics (nanozymes): next-generation artificial enzymes (Ⅱ)
[8]Intrinsic peroxidase-like activity of ferromagnetic nanoparticles
[9]Nanozymes: from new concepts, mechanisms, and standards to applications
[10]eg occupancy as an effective descriptor for the catalytic activity of perovskite oxide-based peroxidase mimics
[11]浅谈纳米酶的高效设计策略
[12]Design of high performance nanozymes: a single-atom strategy
[13]Protein-protected metal nanoclusters: an emerging ultra-small nanozyme
[14]Nanozymes: created by learning from nature
[15]Data-informed discovery of hydrolytic nanozymes
[16]A review on metal-and metal oxide-based nanozymes: properties, mechanisms, and applications
[17]Nanozymes: classification, catalytic mechanisms, activity regulation, and applications
[18]Carbon nanozymes: enzymatic properties, catalytic mechanism, and applications
[19]Enzyme-mimicking capacities of carbon-dots nanozymes: properties, catalytic mechanism, and applications-a review
[20]Nanozymes in bionanotechnology: from sensing to therapeutics and beyond
[21]HU Y H, CHENG H J, ZHAO X Z, et al.
Surface-enhanced Raman scattering active gold nanoparticles with enzyme-mimicking activities for measuring glucose and lactate in living tissues
[J]. ACS Nano, 2017, 11(6): 5558-5566.
[22]PRATSINIS A, KELESIDIS G A, ZUERCHER S, et al.
Enzyme-mimetic antioxidant luminescent nanoparticles for highly sensitive hydrogen peroxide biosensing
[J]. ACS Nano, 2017, 11(12): 12210-12218.
[本文引用: 1]
[23]WEI H, WANG E K.
Fe3O4 magnetic nanoparticles as peroxidase mimetics and their applications in H2O2 and glucose detection
[J]. Analytical Chemistry, 2008, 80(6): 2250-2254.
[本文引用: 1]
[24]DUAN D M, FAN K L, ZHANG D X, et al.
Nanozyme-strip for rapid local diagnosis of Ebola
[J]. Biosensors and Bioelectronics, 2015, 74: 134-141.
[本文引用: 3]
[25]CHANG M Y, HOU Z Y, WANG M, et al.
Single-atom Pd nanozyme for ferroptosis-boosted mild-temperature photothermal therapy
[J]. Angewandte Chemie International Edition, 2021, 60(23): 12971-12979.
[本文引用: 1]
[26]CHEN Y, ZOU H, YAN B, et al.
Atomically dispersed Cu nanozyme with intensive ascorbate peroxidase mimic activity capable of alleviating ROS-mediated oxidation damage
[J]. Advanced Science, 2022, 9(5): 2103977.
[本文引用: 1]
[27]MEI L Q, ZHU S, LIU Y P, et al.
An overview of the use of nanozymes in antibacterial applications
[J]. Chemical Engineering Journal, 2021, 418: 129431.
[本文引用: 3]
[28]FAN K L, XI J Q, FAN L, et al.
In vivo guiding nitrogen-doped carbon nanozyme for tumor catalytic therapy
[J]. Nature Communications, 2018, 9: 1440.
[本文引用: 1]
[29]ZHAO S, DUAN H X, YANG Y L, et al.
Fenozyme protects the integrity of the blood-brain barrier against experimental cerebral malaria
[J]. Nano Letters, 2019, 19(12): 8887-8895.
[本文引用: 1]
[30]REN E, ZHANG C, LI D F, et al.
Leveraging metal oxide nanoparticles for bacteria tracing and eradicating
[J]. View, 2020, 1(3): 20200052.
[本文引用: 1]
[31]ATTAR F, SHAHPAR M G, RASTI B, et al.
Nanozymes with intrinsic peroxidase-like activities
[J]. Journal of Molecular Liquids, 2019, 278: 130-144.
[32]JIANG D W, NI D L, ROSENKRANS Z T, et al.
Nanozyme: new horizons for responsive biomedical applications
[J]. Chemical Society Reviews, 2019, 48(14): 3683-3704.
[33]SUN H J, GAO N, DONG K, et al.
Graphene quantum dots-band-aids used for wound disinfection
[J]. ACS Nano, 2014, 8(6): 6202-6210.
[本文引用: 2]
[34]TAINER J A, ROBERTS V A, GETZOFF E D.
Protein metal-binding sites
[J]. Current Opinion in Biotechnology, 1992, 3(4): 378-387.
[本文引用: 1]
[35]CHAKRABARTI P.
Geometry of interaction of metal ions with histidine residues in protein structures
[J]. Protein Engineering, Design and Selection, 1990, 4(1): 57-63.
[本文引用: 1]
[36]BALA T, PRASAD B L V, SASTRY M, et al.
Interaction of different metal ions with carboxylic acid group: a quantitative study
[J]. The Journal of Physical Chemistry A, 2007, 111(28): 6183-6190.
[本文引用: 1]
[37]CHAKRABARTI P.
Systematics in the interaction of metal ions with the main-chain carbonyl group in protein structures
[J]. Biochemistry, 1990, 29(3): 651-658.
[本文引用: 1]
[38]AN F F, ZHANG X H.
Strategies for preparing albumin-based nanoparticles for multifunctional bioimaging and drug delivery
[J]. Theranostics, 2017, 7(15): 3667-3689.
[本文引用: 1]
[39]BAL W, SOKOŁOWSKA M, KUROWSKA E, et al.
Binding of transition metal ions to albumin: sites, affinities and rates
[J]. Biochimica et Biophysica Acta, 2013, 1830(12): 5444-5455.
[本文引用: 1]
[40]LARSEN M T, KUHLMANN M, HVAM M L, et al.
Albumin-based drug delivery: harnessing nature to cure disease
[J]. Molecular and Cellular Therapies, 2016, 4: 3.
[本文引用: 3]
[41]TAN Y L, HO H K.
Navigating albumin-based nanoparticles through various drug delivery routes
[J]. Drug Discovery Today, 2018, 23(5): 1108-1114.
[本文引用: 1]
[42]HUANG G N, ZANG J K, HE L Z, et al.
Bioactive nanoenzyme reverses oxidative damage and endoplasmic reticulum stress in neurons under ischemic stroke
[J]. ACS Nano, 2022, 16(1): 431-452.
[本文引用: 1]
[43]HAN L, ZHANG H J, CHEN D Y, et al.
Protein-directed metal oxide nanoflakes with tandem enzyme-like characteristics: colorimetric glucose sensing based on one-pot enzyme-free cascade catalysis
[J]. Advanced Functional Materials, 2018, 28(17): 1800018.
[本文引用: 1]
[44]CRIVELLI B, PERTEGHELLA S, BARI E L, et al.
Silk nanoparticles: from inert supports to bioactive natural carriers for drug delivery
[J]. Soft Matter, 2018, 14(4): 546-557.
[本文引用: 1]
[45]YANG R H, FU S Y, LI R D, et al.
Facile engineering of silk fibroin capped AuPt bimetallic nanozyme responsive to tumor microenvironmental factors for enhanced nanocatalytic therapy
[J]. Theranostics, 2021, 11(1): 107-116.
[本文引用: 1]
[46]WILLNER I, BARON R, WILLNER B.
Growing metal nanoparticles by enzymes
[J]. Advanced Materials, 2006, 18(9): 1109-1120.
[本文引用: 1]
[47]ZENG D D, LUO W J, LI J, et al.
Gold nanoparticles-based nanoconjugates for enhanced enzyme cascade and glucose sensing
[J]. The Analyst, 2012, 137(19): 4435-4439.
[本文引用: 1]
[48]LOSADA-GARCIA N, JIMENEZ-ALESANCO A, VELAZQUEZ-CAMPOY A, et al.
Enzyme/nanocopper hybrid nanozymes: Modulating enzyme-like activity by the protein structure for biosensing and tumor catalytic therapy
[J]. ACS Applied Materials & Interfaces, 2021, 13(4): 5111-5124.
[本文引用: 1]
[49]LI X Y, CAO Y F, LUO K, et al.
Highly active enzyme-metal nanohybrids synthesized in protein-polymer conjugates
[J]. Nature Catalysis, 2019, 2(8): 718-725.
[本文引用: 1]
[50]HERRERA ESTRADA L P, CHAMPION J A.
Protein nanoparticles for therapeutic protein delivery
[J]. Biomaterials Science, 2015, 3(6): 787-799.
[本文引用: 1]
[51]SCHOONEN L, HEST J C M VAN.
Functionalization of protein-based nanocages for drug delivery applications
[J]. Nanoscale, 2014, 6(13): 7124-7141.
[52]LEE E J, LEE N K, KIM I S.
Bioengineered protein-based nanocage for drug delivery
[J]. Advanced Drug Delivery Reviews, 2016, 106: 157-171.
[本文引用: 4]
[53]CHOI S H, KWON I C, HWANG K Y, et al.
Small heat shock protein as a multifunctional scaffold: integrated tumor targeting and caspase imaging within a single cage
[J]. Biomacromolecules, 2011, 12(8): 3099-3106.
[本文引用: 1]
[54]MOON H, LEE J S, MIN J, et al.
Developing genetically engineered encapsulin protein cage nanoparticles as a targeted delivery nanoplatform
[J]. Biomacromolecules, 2014, 15(10): 3794-3801.
[本文引用: 1]
[55]MIN J, KIM S, LEE J S, et al.
Lumazine synthase protein cage nanoparticles as modular delivery platforms for targeted drug delivery
[J]. RSC Advances, 2014, 4(89): 48596-48600.
[本文引用: 1]
[56]SAN B H, KIM S, MOH S H, et al.
Platinum nanoparticles encapsulated by aminopeptidase: a multifunctional bioinorganic nanohybrid catalyst
[J]. Angewandte Chemie International Edition, 2011, 50(50): 11924-11929.
[本文引用: 1]
[57]DANIELS T R, DELGADO T, RODRIGUEZ J A, et al.
The transferrin receptor part I: Biology and targeting with cytotoxic antibodies for the treatment of cancer
[J]. Clinical Immunology, 2006, 121(2): 144-158.
[本文引用: 1]
[58]MONTEMIGLIO L C, TESTI C, CECI P, et al.
Cryo-EM structure of the human ferritin-transferrin receptor 1 complex
[J]. Nature Communications, 2019, 10: 1121.
[本文引用: 1]
[59]FAN K L, JIA X H, ZHOU M, et al.
Ferritin nanocarrier traverses the blood brain barrier and kills glioma
[J]. ACS Nano, 2018, 12(5): 4105-4115.
[本文引用: 2]
[60]XING R M, WANG X Y, ZHANG C L, et al.
Characterization and cellular uptake of platinum anticancer drugs encapsulated in apoferritin
[J]. Journal of Inorganic Biochemistry, 2009, 103(7): 1039-1044.
[本文引用: 1]
[61]LIU W, LIN Q, FU Y, et al.
Target delivering paclitaxel by ferritin heavy chain nanocages for glioma treatment
[J]. Journal of Controlled Release, 2020, 323: 191-202.
[本文引用: 1]
[62]ZHAO Y Z, LIANG M M, LI X, et al.
Bioengineered magnetoferritin nanoprobes for single-dose nuclear-magnetic resonance tumor imaging
[J]. ACS Nano, 2016, 10(4): 4184-4191.
[本文引用: 1]
[63]ZHEN Z P, TANG W, GUO C L, et al.
Ferritin nanocages to encapsulate and deliver photosensitizers for efficient photodynamic therapy against cancer
[J]. ACS Nano, 2013, 7(8): 6988-6996.
[本文引用: 1]
[64]ZHEN Z P, TANG W, CHEN H M, et al.
RGD-modified apoferritin nanoparticles for efficient drug delivery to tumors
[J]. ACS Nano, 2013, 7(6): 4830-4837.
[本文引用: 1]
[65]LI X, QIU L H, ZHU P, et al.
Epidermal growth factor-ferritin H-chain protein nanoparticles for tumor active targeting
[J]. Small, 2012, 8(16): 2505-2514.
[本文引用: 1]
[66]KRAMER R M, LI C, CARTER D C, et al.
Engineered protein cages for nanomaterial synthesis
[J]. Journal of the American Chemical Society, 2004, 126(41): 13282-13286.
[本文引用: 1]
[67]HOSEIN H A, STRONGIN D R, ALLEN M, et al.
Iron and cobalt oxide and metallic nanoparticles prepared from ferritin
[J]. Langmuir, 2004, 20(23): 10283-10287.
[本文引用: 1]
[68]BUTTS C A, SWIFT J, KANG S G, et al.
Directing noble metal ion chemistry within a designed ferritin protein
[J]. Biochemistry, 2008, 47(48): 12729-12739.
[本文引用: 2]
[69]PENG T, PARAMELLE D, SANA B, et al.
Designing non-native iron-binding site on a protein cage for biological synthesis of nanoparticles
[J]. Small, 2014, 10(15): 3131-3138.
[本文引用: 1]
[70]DOUGLAS T, STRABLE E, WILLITS D, et al.
Protein engineering of a viral cage for constrained nanomaterials synthesis
[J]. Advanced Materials, 2002, 14(6): 415-418.
[本文引用: 1]
[71]GIESSEN T W, SILVER P A.
Converting a natural protein compartment into a nanofactory for the size-constrained synthesis of antimicrobial silver nanoparticles
[J]. ACS Synthetic Biology, 2016, 5(12): 1497-1504.
[本文引用: 1]
[72]ROHL C A, STRAUSS C E M, MISURA K M S, et al.
Protein structure prediction using Rosetta
[J]. Methods in Enzymology, 2004, 383: 66-93.
[本文引用: 1]
[73]KING N P, SHEFFLER W, SAWAYA M R, et al.
Computational design of self-assembling protein nanomaterials with atomic level accuracy
[J]. Science, 2012, 336(6085): 1171-1174.
[本文引用: 1]
[74]DIVINE R, DANG H V, UEDA G, et al.
Designed proteins assemble antibodies into modular nanocages
[J]. Science, 2021, 372(6537): eabd9994.
[本文引用: 1]
[75]GAO R M, TAN H, LI S S, et al.
A prototype protein nanocage minimized from carboxysomes with gated oxygen permeability
[J]. Proceedings of the National Academy of Sciences of the United States of America, 2022, 119(5): e2104964119.
[本文引用: 1]
[76]UCHIDA M, KANG S, REICHHARDT C, et al.
The ferritin superfamily: supramolecular templates for materials synthesis
[J]. Biochimica et Biophysica Acta, 2010, 1800(8): 834-845.
[本文引用: 1]
[77]SUN X R, HONG Y L, GONG Y B, et al.
Bioengineered ferritin nanocarriers for cancer therapy
[J]. International Journal of Molecular Sciences, 2021, 22(13): 7023.
[本文引用: 1]
[78]MOSCA L, FALVO E, CECI P, et al.
Use of ferritin-based metal-encapsulated nanocarriers as anticancer agents
[J]. Applied Sciences, 2017, 7(1): 101.
[本文引用: 1]
[79]ZANG J C, ZHENG B W, ZHANG X Q, et al.
Design and site-directed compartmentalization of gold nanoclusters within the intrasubunit interfaces of ferritin nanocage
[J]. Journal of Nanobiotechnology, 2019, 17(1): 79.
[本文引用: 1]
[80]HUARD D J E, KANE K M, TEZCAN F A.
re-engineering protein interfaces yields copper-inducible ferritin cage assembly
[J]. Nature Chemical Biology, 2013, 9(3): 169-176.
[本文引用: 1]
[81]JENKINS M C, LUTZ S.
Encapsulin nanocontainers as versatile scaffolds for the development of artificial metabolons
[J]. ACS Synthetic Biology, 2021, 10(4): 857-869.
[本文引用: 1]
[82]MCCONNELL S A, CANNON K A, MORGAN C, et al.
Designed protein cages as scaffolds for building multienzyme materials
[J]. ACS Synthetic Biology, 2020, 9(2): 381-391.
[本文引用: 1]
[83]JIANG B, FANG L, WU K M, et al.
Ferritins as natural and artificial nanozymes for theranostics
[J]. Theranostics, 2020, 10(2): 687-706.
[本文引用: 2]
[84]HE J Y, FAN K L, YAN X Y.
Ferritin drug carrier (FDC) for tumor targeting therapy
[J]. Journal of Controlled Release, 2019, 311/312: 288-300.
[本文引用: 1]
[85]Protein nanocages that penetrate airway mucus and tumor tissue
[86]Hypoxia-tropic protein nanocages for modulation of tumor- and chemotherapy-associated hypoxia
[87]Modular assembly of tumor-penetrating and oligomeric nanozyme based on intrinsically self-assembling protein nanocages
[88]Biomimetic design of mitochondria-targeted hybrid nanozymes as superoxide scavengers
[89]Bioorthogonal catalytic nanozyme-mediated lysosomal membrane leakage for targeted drug delivery
[90]Nanozyme-powered giant unilamellar vesicles for mimicry and modulation of intracellular oxidative stress
[91]Rare earth nanoparticles prevent retinal degeneration induced by intracellular peroxides
[92]Advances and prospects of using nanocrystalline ceria in prolongation of lifespan and healthy aging
[93]Superoxide dismutase nanozymes: an emerging star for anti-oxidation
[94]Hypoxia-tropic nanozymes as oxygen generators for tumor-favoring theranostics
[95]A unifying mechanism for mitochondrial superoxide production during ischemia-reperfusion injury
[96]Magnetoferritin nanoparticles for targeting and visualizing tumour tissues
[97]Biomineralization synthesis of the cobalt nanozyme in SP94-ferritin nanocages for prognostic diagnosis of hepatocellular carcinoma
[98] structure, mechanism, and biochemistry
[99]Reactive oxygen species (ROS) as pleiotropic physiological signalling agents
来源:合成生物学、IVD原料网
声明:本平台注明来源的稿件均为转载,仅用于分享,不代表平台立场,如涉及版权等问题,请尽快联系我们,我们第一时间更正,谢谢!






