单分子检测对于了解机体细胞的物理、化学性质及其参与细胞正常功能的机制是十分必要的。通过这种方式,可以为医疗保健系统提供一个新的方向。为成功地检测它们,人们开发和使用了各种技术。在此,我们综述了各种传统方法以及提供单分子灵敏度的生物传感技术。本文首先讨论了等离子体共振、纳米孔、回音壁模式(WGM)、单分子检测和蛋白单分子测序等多种方法,随后讨论了基于生物传感器的检测技术。等离子体、SERS、CRISPR/Cas和其他类型的生物传感器在单分子检测中具有很高的敏感性。在过去的一、二十年,已经开发和设计了各种技术和实验来检测单个分子。自20世纪50年代以来,在单分子水平上进行了各种各样的生物分子研究实验。例如,霍尔在1956年使用透射电子显微镜拍摄了DNA和蛋白质(胶原蛋白)等单分子的第一张图像,由于生物分子中存在低原子序数的碳原子,因此这是一项繁琐的任务。1961年,有学者开展了间接检测水溶性生物分子的荧光研究。小液滴通常是由于雾化而形成的,并表现出荧光,研究利用这一原理对荧光进行检测,按0、1、2、3、4等顺序显示了含有高浓度底物的低浓度酶的液滴中存在的分子数量。1970年,膜片钳(Apatch Clamp)被用于研究单分子,此后被广泛应用于离子通道蛋白的研究。1976年初,用荧光材料标记的生物大分子,即球蛋白单分子被鉴定出来,1982年,利用可扩散的多重荧光标记技术检测了单脂质分子。1988年,利用单个驱动蛋白电机对塑料微球的中心进行了研究。Moerner和Kador于1989年通过吸收法首次观察到凝聚态物质中的单分子极限。此外,Orriti和Bernard在1990年首次检测到一种被称为并五苯单分子的荧光信号。1993~1995年,应用宽场单荧光成像技术对单荧光团分子进行检测和成像。1996年鉴定了单一罗丹明标记的脂质,利用单分子荧光定位技术获得了大约30nm的分辨率。2000年开始在单分子水平上对活细胞进行直接成像,研究人员只使用了一种荧光染料标签,并通过荧光显微镜进行观察。在过去的十年中,很少有新颖的自动化和生物计算技术被开发用于单分子检测,包括核密度估计,保边滤波器和贝叶斯推理等。直至2013年,通过贝叶斯推理确定了单分子的空间动力学。随着近场扫描显微镜、光激活定位显微镜、受激发射损耗显微术或超分辨率荧光显微镜等先进显微技术的发展,单分子的超分辨率成像成为可能。这些技术用于基于标签的远场单分子成像,以及无标记的单分子相互作用近场检测。此外,随着纳米生物技术的发展,几种先进的纳米技术也在更大程度上发挥着指导作用。其中,发生在单分子检测方面的主要标志性事件如图1所示。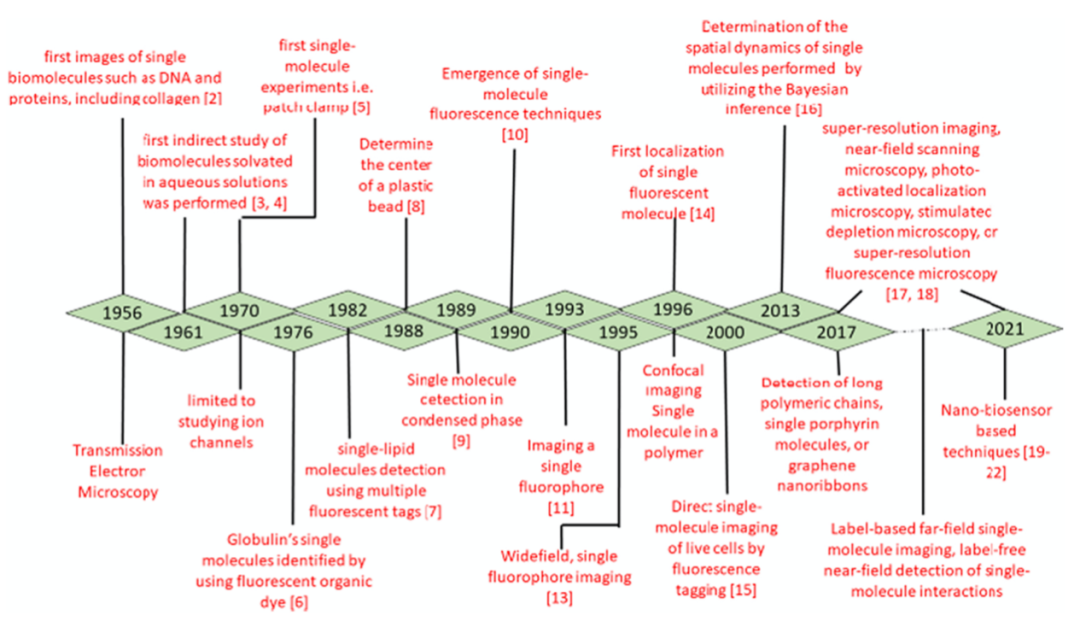
图1
所有的生物过程都直接或间接地依赖于分子反应。这些生物分子组装成分子机器来执行各种重要的细胞功能,例如蛋白质合成仪、呼叫信号和DNA转录处理仪。因此,测量它们的浓度对于检测包括癌症在内的多种疾病是非常重要的。单分子检测的其他重要生物应用有:快速DNA测序、生物样本的法医病理学分析和医学诊断。单分子检测是动植物系统分子生物物理学的重要组成部分,荧光显微镜、纳米孔、电子显微镜和原子力显微镜用于单分子检测,一组分子的整体行为和性质不同于单个分子。单分子检测可以观察复杂混合物的基本分子特性,从而能够在早期绘制或诊断疾病,有助于提供任何生物分子相互作用的分子动力学分布信息。这些技术,如纳米孔,也可以毫不费力和快速地对DNA进行排序。在这篇综述中,我们概述了几种包括传统的和现代的,用于检测单个分子的技术。
在这部分回顾中,我们强调了几十年来用于单分子检测的各种技术,这些技术主要依赖于成像技术,如显微镜和光谱学。在此,我们针对它们的应用、优点和缺点等进行讨论。酶标记技术广泛应用于生物分析。在该技术中,化学标记与物质中的分子相结合。酶标记技术能够在物质的化学分析过程中检测和追踪分子。目前已有各种类型的酶标记被报道,可用于单个分子的生物标记。自1970年以来,酶标记法已被用于几种生物标志物的检测。该技术通常用于疾病筛查、医疗诊断、研究目的和法医病理学检验。酶标记有助于结合分子的定量分析,例如,检测样品中的药物水平。在生物系统分析中,酶标记可以提供关于基因组完整性的几个关键信息。这有助于对系统发生的损伤提供准确的测量,如在功能和基因表达调控中发挥关键作用的DNA损伤。一项研究表明,通过将单分子检测与酶标记相结合,可以量化DNA损伤。本研究中使用的酶是生物素,用于标记受损的三磷酸脱氧核苷酸(dNTPs),将其从正常DNA中分离出来。该方法能够以极低的丰度(1.3×10-4%)提供特定基因DNA序列中任何损伤的信息。这项技术常用于检测癌细胞中的DNA损伤。通过这种技术,可以获取蛋白质的活性位点,这对研究蛋白质的表达和定位非常有帮助。该技术还可有效地用于改善基于蛋白质和生物利用度的药物的药代动力学。然而,一些荧光探针在使用上存在局限性,因为许多蛋白质不兼容,从而导致功能和/或细胞内分布受损。纳米孔可以被描述为一种纳米大小的孔,它是由成孔蛋白或合成材料,如硅和石墨烯形成的。例如,当纳米孔存在于具有电绝缘性能的膜中时,可用于单个分子的检测;生物蛋白通道在脂质双分子层内,固体膜或合成蛋白通道设置在合成膜内。当电压被施加在带有纳米孔的膜上时,离子电流通过它,最终被用于监测单个分子的检测,这是一种被广泛接受的单分子检测技术。纳米孔技术具有重复性高、操作简单、成本低、有助于理解单分子行为的特点,利用类似气溶胶的纳米孔对聚(dA)n(n=4,5)DNA样品进行检测。纳米孔技术主要用于DNA和蛋白质的测序。纳米孔测序的主要优点是机器非常小,只需要很少的功率和试剂,但同时,它也容易出错。一旦纳米孔系统一旦以不允许光传播的方式建立,那就被称为零模波导(zero-mode waveguides)。这种现象通常见于波长大于孔径的金属薄膜孔中,且分子仍然能够通过这些孔隙。该方法用于检测通过零模波导的荧光团标记分子。金属薄膜是用钯制成的,用荧光团标记的分子从黑暗区域向被照亮的一侧移动并发出光,该技术可起到本底抑制作用,避免过早漂白,可用于DNA和蛋白质生物分子的检测和单分子生物物理研究。2017年有研究描述了一种基于光谱的单分子纳米孔来表征水溶性肽。这项技术的基本概念是利用生物蛋白的纳米孔来分解不同大小的分子。在本研究中,Au25(SG)18个聚类用于提高肽对孔的开关率。溶剂/溶液的pH值对提高多肽的柔韧性也有重要作用,在单分子检测中表现出波动。该研究根据当前的封锁深度确定了肽的质量,从而将质量分辨率提高了2倍。在过去的几十年里,等离子体共振或表面等离子体共振(SPR)也成为一种流行的检测单个分子的方法,它也可以用于测试各种研究的粗样品,如血清分析,其主要优点是成本低,耗时短,不需要预处理样品。它是一种代表振荡事件的现象,即入射光的光子以一定的入射角撞击表面电子而被激发。SPR主要用于测量材料在金/银金属表面的吸附,利用SPR原理制备纳米线,将有序的金纳米颗粒以纳米线方式排列在银起皱结构的尖端。等离子体增强检测可直接对完全无荧光和弱发射的物种进行光学检测。等离子体增强单分子检测有两种策略:等离子体增强弱荧光生物分子发射和监测单分子相互作用引起的等离子体共振位移。利用分子信标结合等离子体信号检测缓冲液和热灭活血清中寨卡病毒大特异性人工DNA/RNA。该系统增强了特异性信号,有助于检测特定的靶向核酸。这种方法对小核苷酸变异的敏感性使其能够鉴别密切相关的病原体。此外,所实现的信号增强是通过技术上简化的信号检测实现的,为基于单分子的POCT铺平了道路。然而,该技术有一些局限性,包括所使用的配体定向阻碍了分析物的空间结合。拉曼散射显微术是基于液体中散射特性的一般原理。早在20年前就有人预测,可能利用该技术检测单个分子和DNA测序极具前景。拉曼散射显微镜用于化学键成像具有不同特性,例如高灵敏度,高特异性,快速和高分辨率。它允许生物医学相关系统的无标志成像。在拉曼散射显微技术中,不需要对样品进行预处理并很快给出结果。这是一种无损技术,任何形式的样品,如固体、液体和蒸汽,都可以通过聚合物或玻璃包装进行研究。拉曼散射显微技术对内源性生物分子的成像灵敏度仅为~10mM,亚微摩尔生色团的检测也可通过该技术实现。到目前为止,这种技术的各种优化形式已经被开发出来,以实现对极小的单一生物分子的高灵敏度检测(拉曼截面范围为~10-30cm2sr-1)。研究表明,高速振动光谱成像技术可用于单细胞到组织的成像,该无标记受激拉曼散射显微镜可以在复杂的生物环境中对400~1800cm-1的指纹区域的多种化学物质进行分辨。所开发的平台是基于指纹光谱的受激拉曼散射。该技术也有一些局限性,不能用于合金或金属,需要高灵敏度和优化的仪器。拉曼光谱可以被杂质的荧光阻隔,有时也可以被样品自身阻隔。利用裂结技术开发单分子电触点。一般来说,断裂结是一种电子设备形式,包含两根金属线,它们之间有非常细的间隙,小于一纳米。这些类型的器件可以通过物理牵引、电迁移或化学腐蚀来开发。利用该技术对单分子二氢苯进行了检测。单分子裂结技术允许通过在两端加入锚定基团来实现单分子二氢苯的电荷转移特性。这有助于控制锚定配置。单分子裂结技术被研究人员用于检测由二氢苯/乙烯基七氟乙烯组成的光致变色系统的光热反应。该技术用于定量分析,测量异构化、可逆性和/或反应动力学。单分子裂结技术的独特优势在于它可以研究极低温实验中从表面的一点到另一点的性能。此外,还报道了该技术在结构成像时的一些缺点。在单分子裂结技术中,固态栅极的加入也是一个挑战,然而,它在单分子电荷输运特性的研究中起着重要的作用。全内反射荧光显微镜(简称TIRFM)是一种光学显微镜技术,用于观察表面和界面上单个分子的荧光。通常用于研究分子与其表面的相互作用。如图2所示,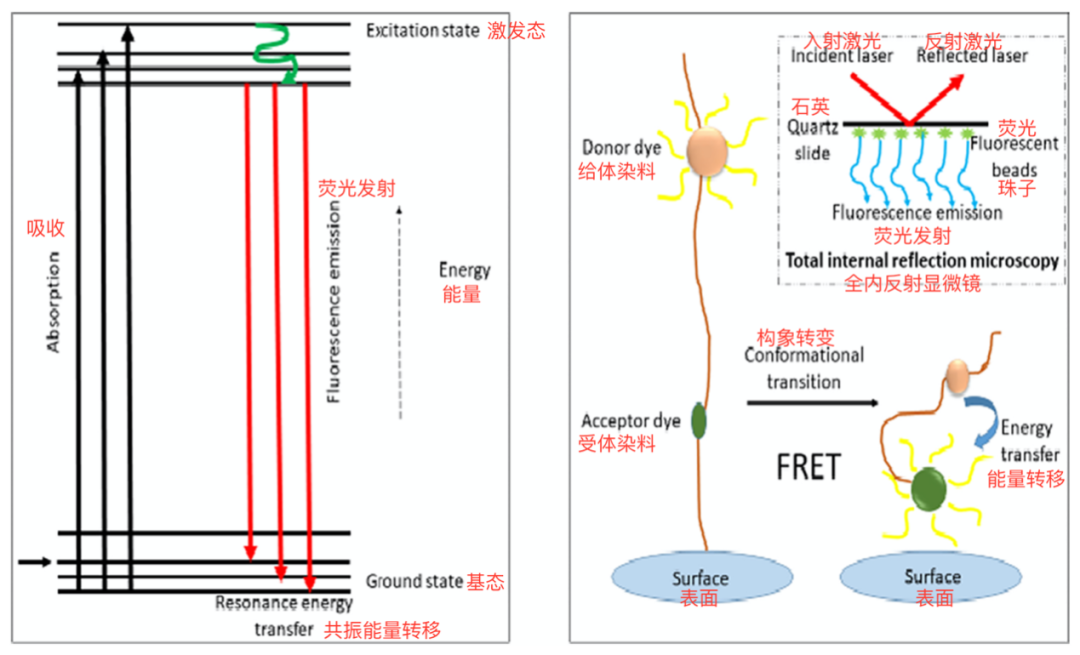
图2
在TIRFM技术中,荧光团在样品的一个薄区域内被激发。这样,只有表面封闭的荧光分子被激活,基本上是基于激发光在透明固体表面内全反射的原理,发射时产生相同的频率。TIRF法广泛应用于单分子的检测。TIRFM能够提供与通道位置相关的空间信息,并适用于膜片钳移液管不可访问的通道。它还允许同时记录多个通道。我们进行了一项研究,通过结合荧光标记抗体的TIRF单分子检测来检测组蛋白修饰酶。通过该方法检测组蛋白乙酰转移酶和组蛋白甲基转移酶,检出限分别为21pm和12pm。结果表明,该方法灵敏度高,选择性好,特异性也很好。此外,该技术在单分子检测中也存在一些不足,在这个显微系统中,物镜被放置在样品的同侧,与瞬逝场相对。因此,我们要么用很薄的样品,要么用水浸式物镜。单分子阵列技术通常用于蛋白质分子的超灵敏检测。它使检测外周血生物标志物评估免疫治疗成为可能。最近的一项研究是用单分子阵列技术分析法定量分析血浆中的系统性细胞因子水平,并将其与健康患者进行比较,观察生理变化。简而言之,它是基于在顺磁珠上分离出单个荧光标记的免疫复合物,这些免疫复合物最终装载在单分子阵列技术disc盘上,荧光测定与ELISA分析技术相似。单分子阵列技术分析法是研究血液中可溶性信号分子的最佳方法,即使是在毫微升范围内,该技术高度、灵敏、快速,可用于检测复杂生物样品中的单分子。超细光纤表现出与波导和可定制的光约束有关的显著特性,而波导的色散和倏逝场也可以报道。基于光纤的单分子检测因其高灵敏度、高柔性、低光功耗和小型化的光学传感器等特点而受到众多研究者的关注。为提高光纤的灵敏度,他们与等离子体纳米界面结合,即与黑磷负载的金纳米杂化、功能化。在本研究中,研究人员在10zM到100nM的线性范围内检测了epidermal生长因子受体(ErbB2)。计算出检测限为6.72zM,可以在单分子水平上检测生长因子,通过该技术,可以将正常细胞和癌细胞分化,利用光热疗法对癌细胞进行进一步治疗。因此,它可以用于早期诊断和治疗。该光纤具有设备成本低、可靠性高、安装简单等优点。然而,在这种方法中,很难保持微纤维的均匀性和直径,这种方法的发射输出功率会受到一些不需要的因素,如光波动的影响。回音壁模式是单分子检测的高灵敏度标志免费平台。回音壁模式技术被用来检测不同类型的生物分子以及化学离子。回音壁模式的基本原理是波在凹面上的传播和光谱性质的变化,表现为光波长共振,其共振光谱位置取决于微谐振器材料的折射率和半径。它使亚kDa分子量范围内的单分子检测成为可能,且在单分子或化学检测中,主要采用回音壁模式的频移。图3显示了棱镜表面的全内反射激发形式的回音壁模腔,图中还显示了添加金纳米粒子后产生的驻波模。金表面小分子相互作用后,可观察到驻波模式的变化。回音壁模式具有高灵敏度、易于制造、低成本、易于功能化的优点,但该技术也显示出一些局限性,除了化学或生化反应外,频率或波长也可能受到其他因素(如机械振动和外部环境的热波动)的影响。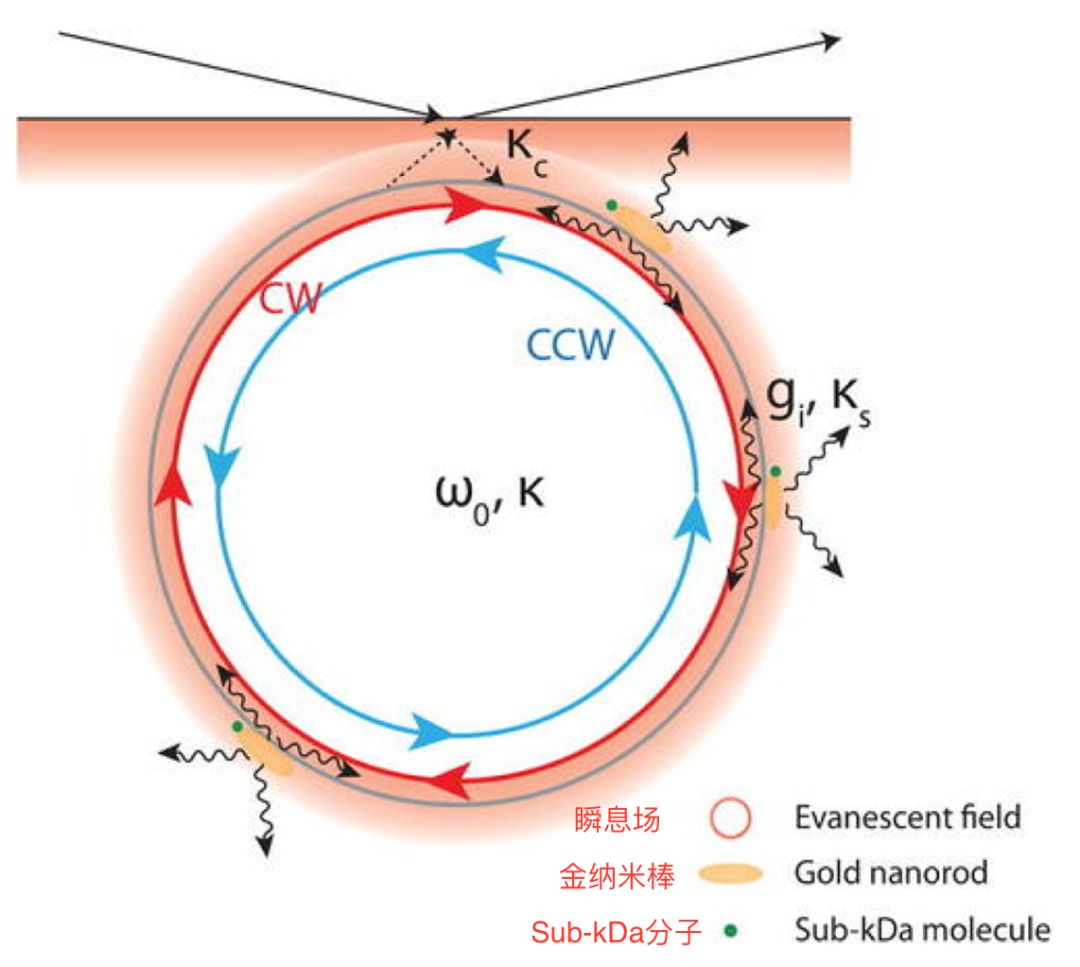 荧光共振能量转移(FRET)是一个非辐射的转移能量从供体(激发荧光团)到受体(另一个荧光团)的过程,这是一个依赖距离的物理过程,涉及分子间的远距离偶极-偶极耦合。该技术主要依赖于捕捉荧光信号的能力,荧光信号是通过固定或单个活细胞中标记分子或荧光团的相互作用产生的。这种技术中使用的荧光团有很宽的吸收波段,允许在单一波长同时激发不同颜,因此适用于多路复用应用。在FRET技术中,各种类型的探针被使用,包括光收集纳米颗粒。2020年,基于光收集纳米粒子(纳米天线)的探针被FRET技术用于检测寡核苷酸。这些纳米天线经DNA功能化处理后,对单一杂交分子的FRET受体的效率为50%。在本研究中,FRET受体是一种光稳定染料MATTO665,可使信号放大250倍。基于FRET的技术被发现在短RNA/DNA序列的单分子检测、成像单个杂交事件和编码癌症生物标志物方面非常可靠。FRET也有一些局限性,如需要复杂的仪器来检测信号、复杂的光谱反褶积和数据分析等,一些荧光团表现出低量子产率,对光和化学降解的敏感性以及pH敏感性。除了相同的化学组成,每个分子都有不同的性质,例如,不同的分子有不同的速度。因此,由于多普勒频移,分子吸收不同的外部频率。这种现象被用来表征或检测存在于异相溶液中的不同分子。几年来,几种光谱和显微技术与其他先进技术相结合被广泛应用。例如,1994年使用共聚焦显微镜与激光束(衍射受限)结合,在室温条件下,利用液相技术对单个荧光分子进行检测。从那时起,到目前为止,已经在实验设计中做了几个改动。此外,荧光相关光谱学可以提供分子间相互作用和扩散的信息,它取决于各种因素,如颗粒的大小,构象波动和生物系统的异质性。同样,生命期造影显微术有助于在不同区域绘制荧光团的寿命。已知能在200纳米大小的个别区域内记录荧光团的寿命及其发射光谱。核磁共振波谱和质谱也被用来检测氨基酸和核苷酸序列。1.对事件过程的研究在每一步都是可能的,但在分子群体中是不可能的。2.通过测量光谱可以观察到重叠跃迁和构象异质性的数量和一致性。3.研究单分子的结合力、键合强度、扭矩、电导率、二级结构和三级结构是有效的可能。然而,也有一些缺点,如低信号,详细信息和时间分辨率之间的权衡。
荧光共振能量转移(FRET)是一个非辐射的转移能量从供体(激发荧光团)到受体(另一个荧光团)的过程,这是一个依赖距离的物理过程,涉及分子间的远距离偶极-偶极耦合。该技术主要依赖于捕捉荧光信号的能力,荧光信号是通过固定或单个活细胞中标记分子或荧光团的相互作用产生的。这种技术中使用的荧光团有很宽的吸收波段,允许在单一波长同时激发不同颜,因此适用于多路复用应用。在FRET技术中,各种类型的探针被使用,包括光收集纳米颗粒。2020年,基于光收集纳米粒子(纳米天线)的探针被FRET技术用于检测寡核苷酸。这些纳米天线经DNA功能化处理后,对单一杂交分子的FRET受体的效率为50%。在本研究中,FRET受体是一种光稳定染料MATTO665,可使信号放大250倍。基于FRET的技术被发现在短RNA/DNA序列的单分子检测、成像单个杂交事件和编码癌症生物标志物方面非常可靠。FRET也有一些局限性,如需要复杂的仪器来检测信号、复杂的光谱反褶积和数据分析等,一些荧光团表现出低量子产率,对光和化学降解的敏感性以及pH敏感性。除了相同的化学组成,每个分子都有不同的性质,例如,不同的分子有不同的速度。因此,由于多普勒频移,分子吸收不同的外部频率。这种现象被用来表征或检测存在于异相溶液中的不同分子。几年来,几种光谱和显微技术与其他先进技术相结合被广泛应用。例如,1994年使用共聚焦显微镜与激光束(衍射受限)结合,在室温条件下,利用液相技术对单个荧光分子进行检测。从那时起,到目前为止,已经在实验设计中做了几个改动。此外,荧光相关光谱学可以提供分子间相互作用和扩散的信息,它取决于各种因素,如颗粒的大小,构象波动和生物系统的异质性。同样,生命期造影显微术有助于在不同区域绘制荧光团的寿命。已知能在200纳米大小的个别区域内记录荧光团的寿命及其发射光谱。核磁共振波谱和质谱也被用来检测氨基酸和核苷酸序列。1.对事件过程的研究在每一步都是可能的,但在分子群体中是不可能的。2.通过测量光谱可以观察到重叠跃迁和构象异质性的数量和一致性。3.研究单分子的结合力、键合强度、扭矩、电导率、二级结构和三级结构是有效的可能。然而,也有一些缺点,如低信号,详细信息和时间分辨率之间的权衡。
此外,单分子相关的力和运动可以通过力光谱技术,如光学镊,磁镊和原子力显微镜来检测。光镊和磁镊是用来研究单分子性质的科学仪器。光镊使用高度聚焦的光束,这有助于像镊子一样握住和移动单个分子。激光提供的力是吸引的还是排斥的,这取决于粒子及其周围介质的相对折射率。此外,磁性镊子利用磁场梯度来操纵附着在单分子栓系表面另一侧的顺磁珠,外部磁珠用于操纵所附磁珠。这两种技术都显示了它们自己非常独特的特性,但需要类似的工作流并提供相同的功能。光镊的最大优点是操作简单,用光镊可以实现单个分子,而磁镊在均质力场中工作效果最好,这两种方法都可以方便地拉伸和扭曲大分子物质。原子力显微镜(AFM)是三者中非常常见和熟悉的技术。用AFM用近端探针研究单个分子的表面性质,允许在亚纳米分辨率映射单分子表面特征。AFM也可以对单个分子进行表面修饰和操纵,因此,它是生物应用的一个了不起的工具,还提供了快速和简单的样品制备的易用性,以及方便在同等生理条件下进行检测。这是近十年来出现的一种研究隧道结合中单分子的高效技术。利用化学功能化电极可以确定隧道结中是否存在单分子。在这种技术中,可以监测发生在第一个配体(与电极结合)与其目标分子(与第二电极结合)之间的随机键波动。配体与其靶点的相互作用使人们能够在单分子水平上了解它们的结合性质,这就决定了需要可重现的隧道数据。识别隧道法为单个DNA分子的快速测序创造了电子与化学之间的界面。近年来,为了在单分子水平上研究分子间的相互作用,引入了一种识别分子葫芦脲(CB7),通过这种技术,可以显著地实现单分子的电测量。图4为葫芦脲功能化金表面电导测量示意图。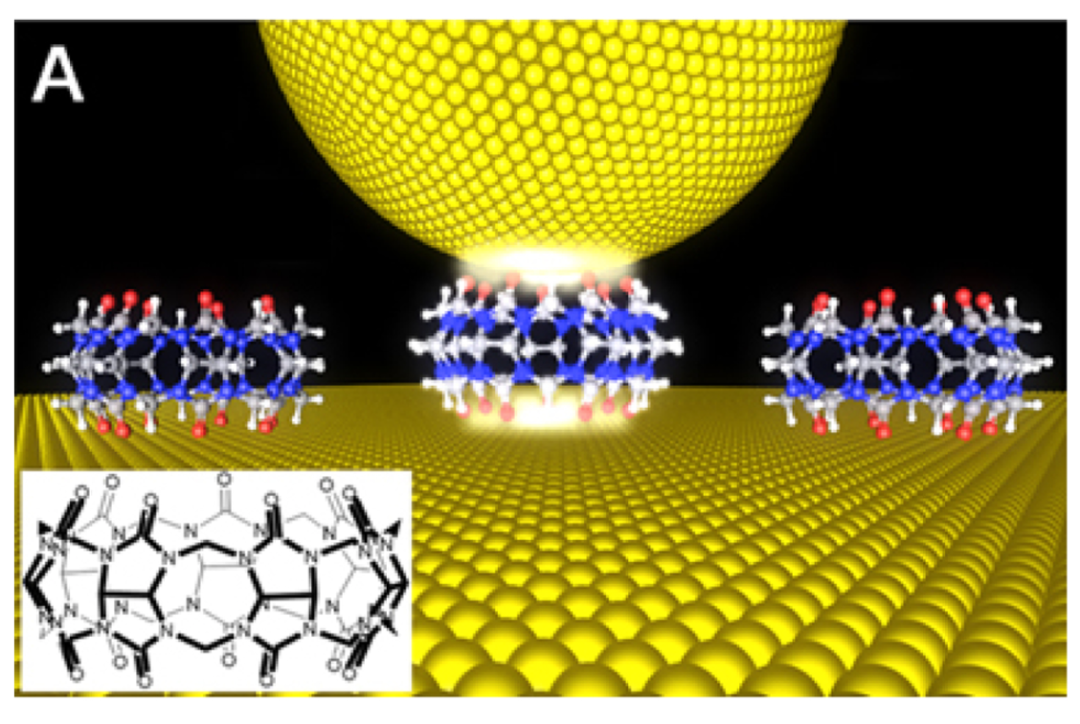
图4
多光子激发荧光显微镜(MEFM)是一种用于检测包括单分子在内的生物分子的显微镜技术。在过去的几十年里,它的应用在组织工程、生物技术、材料科学和其他临床成像需求等不同领域得到了广泛的发展。荧光领域的各种进展,如发色团和量子点的发展,为多光子激发显微术提供了一个新的方向。该检测技术具有广谱吸收光谱,是利用自体荧光技术进行组织谱分析的有利方法。此外,多光子激发导致较少的光漂白和更深的穿透点测量。采用多光子诱导荧光技术检测了单分子二甲胺(DMAthaU)。研究人员使用脉冲形状的宽带钛和蓝色激光激发来检测DMAthaU。结果表明,当入射强度较低时,2个光子吸收发生变化。然而,在高激发功率下,它被转换为3个光子吸收。DMAthaU在两个光子和三个光子的激发下都表现出单分子的亮度。荧光碱基类似物五环腺嘌呤具有很高的双光子亮度。在一项研究中发现,五环腺嘌呤具有高度的光稳定性,具有高的2光子截面和发射量子产率。他们利用双光子显微镜进行了与五环腺嘌呤结合的寡核苷酸检测,显示了极快的激发和脉冲成形。同时也报道了该技术的一些缺点,如与单光子激发相比吸收较低,从而导致高强度的光子激发对细胞的破坏,此外,还发现一些染料在宽激发下同时被激发,可以产生更强的背景。
目前,生物传感器作为一种检测各种生物分子的先进技术迅速出现。它们具有广泛的应用,包括高灵敏度,低成本,高选择性和易于使用的护理点设备。本节总结了近年来发展起来的各种类型的检测单分子的生物传感器。等离子体纳米结构展示了独特的光学和电子特性,以评估动力学分布和实时单分子结合产生的信号。等离子体展示了分子在纳米尺度上增强的光激发态事件,这足以从光学上检测表面和被分析物之间的任何相互作用。基于纳米等离子体的传感原理依赖于任意表面(特别是金属表面)或纳米结构内自由电子的受光激发振荡,它可以对依赖于光场强度的单个分子提供高度特异性和敏感性的分析。因此,研制了一种单分子传感定位表面等离子体共振平台,用于检测在一段时间内抗原抗体相互作用动力学。研究发现,通过可逆吸附非共价结合的抗PEG抗体是影响等离子体波动的主要因素。开发的技术最适合于检测分子系统在相互作用的早期阶段的性质改变,如质量运输限制。用于研究抗原-抗体相互作用动力学的局部表面等离子体共振传感平台如图5所示。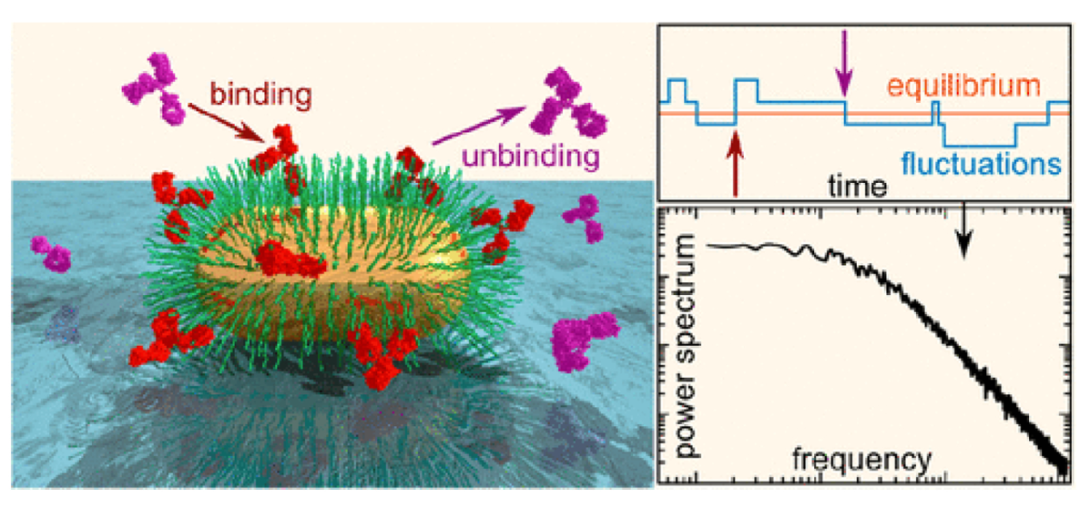
图5
图中表示频率和时域分析,有助于说明单价界抗PEG抗体在表面的可逆吸附主要影响LSPR的波动。单分子检测对于疾病的早期诊断和相关的分子行为也很重要,也有助于基因分析和环境监测。金(Au)和银(Ag)纳米粒子在单分子检测中得到了广泛的应用,近年来,利用金、银核壳纳米立方体开发了一种用于检microRNA的等离子体纳米生物传感器,利用四面体DNA修饰金/银核壳纳米立方体。所开发的传感系统能够实时检测microRNA,具有较大的动态范围(1aM-1nM)和aM级灵敏度。它还允许基于DNA的逻辑运算和生物记忆运算。作为结核病的生物标志物,脂阿拉伯甘露聚糖也通过等离子体栅进行检测,其中包括单分子荧光分析。结合等离子体栅的脂阿拉伯甘露聚糖捕获抗体与人尿液样本和生物素化二抗孵育,用荧光标记链霉亲和素观察单分子发射,所描述的方法能够对结核生物标志物进行无创、高灵敏度的定量。Wang和他的团队最近开发了一种等离子体散射成像方法,该方法可以区分特异性和非特异性结合,用于寻找高灵敏度和选择性的生物标志物,该方法被用来检测由单个纳米颗粒产生的控制热波动的分子结合对。通过分析热波动,可以得到分子结合能、多分子结合能、结合能分布和弹簧常数等信息,该方法通过分子结合对对纳米颗粒进行附着,研究单分子基础上的分子结合。基于等离子体共振的生物传感器,能够在单分子水平上提供卓越的灵敏度。一项研究揭示了等离子体纳米天线与固态纳米孔相结合对DNA单个分子的无标记检测。单分子首先有效地传输到等离子体热点,然后通过等离子体纳米天线产生的背光散射光以亚毫秒的捕获速率进行监测。同样,通过对纳米孔施加电场,生物分子会远离热点,从而最终阻止分子与金传感器表面的永久结合,该技术提高了光学生物传感器的可重用性。在一项研究中,等离子体纳米颗粒被用作一种有效的工具,用于单细胞/分子的无标记检测。最近出现了另一个术语:纳米流体。纳米流体对超小的样品体积(皮升)显示出前所未有的结合能力,提高了检测次数和结合次数。表面增强拉曼散射(SERS)是一种极具潜力的检测拉曼活性物质单分子的技术。近十年来,利用纳米结构衬底对该技术进行了多次改进。SERS技术被广泛应用于生物传感和痕量检测等领域,也是一种非常可靠的快速和常规识别病毒感染的技术。基于SERS的生物传感器表现出卓越的灵敏度,仅需要最少的样品制备量。它们通常利用互补核酸、抗体和适配体作为识别病毒的识别元件。此外,还构造了一个等离子体纳米狭缝来实现局部SERS。纳米孔流体和SERS技术的结合有利于DNA的电动力学捕获,可以有效地对核苷酸进行识别。DNA被暂时吸附在这些纳米孔内,从而启动随机波动过程。在不同的碱基上发现了一种异步的光谱行为,同样,在人类血清样本中,miRNA也通过基于SERS的生物传感器检测到飞摩尔级别浓度水平。该生物传感器基于复合型SRS,用于放大多个信号,用于毫微球检测miRNA。利用含有大体积热点、间隙和尖锐尖端的金泡来增强电磁强度,提高SERS生物传感器的整体性能。在这里,银纳米颗粒也被用于参与第二阶段的扩增,计算出检测限为0.03fM。SERS技术是一种分两步进行单分子蛋白质检测的技术,在医学诊断中经常使用。蛋白质分子在本体溶液中先与连接子连接,然后与SERS底物发生化学反应。再次,利用Trauts试剂对牛血清白蛋白溶液进行硫代化,然后通过巯基将蛋白与金表面交联。光谱波动产生拉曼信号,用闪烁来分析蛋白质的存在,该方法灵敏度高、耗时短、特异性强,适用于单分子蛋白质的检测,通过多种修改,开发出一种耗时少、灵敏度高、操作方便的系统是非常必要的。最近开发了一种类似的生物传感器用于比色检测,为此,研究人员开发了一种适配体功能化的金纳米颗粒,更倾向于在更高浓度的溶液中聚集。在啶虫脒存在的情况下,出现了构象变化,通过圆二色光谱技术进行了验证,导致SERS信号增强,研究表明,SERS信号的增强与扑热息痛的浓度成正比。对乙酰脒浓度范围为3.0×10-8~4.0×10-6M,检出限为1.76×10-8M,该传感器具有良好的成本效益,可用于其他生物分子。场效应晶体管(FET)是利用半导体中的电场来控制电流的,FET技术是一种用于定量分析目标单分子亲和和动力学的生物传感器。基于石墨烯薄片和场效应晶体管开发的生物传感器用于检测药物伊马替尼与其靶向分子蛋白激酶Ab11之间的动力学。该生物传感器的线性浓度范围为0.1pM至10μL。石墨烯-场效应管生物传感器被发现在分析蛋白质和药物(通常是低分子量)相互作用方面很有前途。基于石墨烯通道FET的生物传感器也被用于超灵敏的核酸检测,该生物传感器可以通过测量生物分子的内在特性进行无标记检测。此外,将其与基于硅纳米线的场效应晶体管集成,构建了检测溶液中人α-凝血酶蛋白的生物传感器芯片平台。该研究合并了两个参数,用于检测浓度变化很大的蛋白质,并且由于溶液中存在不同的生物分子,从而提供了更广泛的敏感结果的可能性。利用滞后宽度或与蛋白质分子极化有关的信号测量FET传输曲线。有机场效应管展示了非常强大的工具,为临床相关的单分子生物标志物的标签免费检测,这些是基于电解质,即(生物识别元素功能化)控场效应晶体管的小型化、低成本单分子晶体管。通过该生物传感器,可以达到单分子检测极限,用于多发性硬化症基因组生物标志物的检测。制作了一个毫米大小的带有识别元件的FET,用于单分子的无标记检测。一端的场效应管以自组装单层的形式被功能化,能够捕获抗IgG,并具有与靶分子相互作用的氢键网络。FET通过在门控域中传播触发亲和绑定事件来实现,这种类型的传感系统可以有效应用于临床,以检测单一生物标记的症状的进展和发病机制研究发现,该装置可用于检测具有“开关”机制的特异性蛋白或生物标志物的存在与否。有序聚类间隔短回文重复序列(CRISPR)是原核生物基因组DNA序列的一组/家族。这些序列通常被用来检测、编辑和破坏相同的噬菌体感染的基因。CRISPR-Cas被统称为一种基因组编辑技术,它可以删除、改变和添加核苷酸序列片段。它也可用于体液中miRNA的检测。基于CRISPR-Cas的生物传感器由于目标扩增而表现出更高的灵敏度,建立了一种基于CRISPR-Cas的生物传感系统,用于检测细胞提取物和血清等复杂生物体液中检测限为1.33fM的单分子(miRNA)。该技术还被用于检测引起宫颈癌的人乳头瘤病毒,研究人员开发了一种结合环介导等温扩增、CRISPR-Cas和横向流动生物传感器检测人乳头瘤病毒株16和18型的方法。此外,该系统还可用于其他传染病的检测,灵敏度高,可检测3.1个靶基因组DNA。利用CRISPR-Cas技术,开发了单微环谐振器生物传感平台,用于蜱媒疾病的检测。该平台可实现对细菌寡核苷酸序列的无标记实时检测,恙虫病的敏感性为0.54aM,发热伴血小板减少综合征的敏感性为0.63aM。同样,最近开发了一种以CRISPR-Cas技术为动力的双模式生物传感器(即光学和热传感器),用于检测致病菌(沙门氏菌)。他们还强调了金纳米粒子介导的CRISPR-Cas光热效应,双模式生物传感器使交叉验证细菌存在于食品样品,这样可以双重确认病原体,具有较高的敏感性和特异性。例如,CRISPR-Cas技术结合其他技术可以为单分子检测提供高选择性和灵敏度;基于CRISPR-Cas的核酸靶点和ATP检测aptassensor。基于CRISPR/Cas12a的电化学生物传感方法检测单核增生李斯特菌和循环肿瘤DNAs。核酸(RNA/DNA)检测或诊断,结合横向流动生物传感器检测核酸。最近报道了一种用于RNA检测的液滴微流体检测法。该方法涉及基于Cas13a的单分子RNA检测。液滴微流控系统提高了靶向分子和报告因子的局部浓度,最终使生物传感器的灵敏度提高了超2万倍,因此基于液滴的微流控技术可以通过更简单的方式检测广泛的单分子RNA。电化学生物传感器是开发实时传感器件最可靠的方法。电化学生物传感器是一种利用不同的生物识别元件如抗原/抗体、寡核苷酸(DNA/RNA/核酸适体)、全细胞(病毒/细菌)和分子印迹聚合物来检测单个分子的新时代设备。电化学生物传感器因其简单、响应速度快、灵敏度高而受到广泛的青睐。事实上,对于单分子的定性和定量检测,无标记的电化学生物传感器是首选的标记方法。电化学免疫传感器的发展需要考虑一些重要的性能参数,如灵敏度、选择性、纳米材料的导电性、传感平台的表面积、电极表面的功能化等,其中最重要的是抗原和抗体的结合能力。近年来,一种基于多壁碳纳米管和氧化锌的无标记电化学免疫传感器被开发,主要用于农药的检测,其包覆的MWCNTs和ZnO纳米颗粒具有很高的电导率、较低的带隙和较大的表面积,提高了灵敏度,线性范围和检出限分别为10zM-1μM和5.368zM,所开发的传感平台具有选择性和可重复性。近年来,微流体技术在世界范围内受到广泛关注。微流体通道与电化学免疫传感器等传感装置集成,用于定量检测蛋白质生物标志物或其他分析物。唾液中的可替宁水平用基于竞争结合试验的微流控免疫传感器,该检测平台的最低检出限为6×10-2pg ml-1,线性范围为1×10-1~1×104pg ml-1,适用于棉签采集唾液。用这种基于微流控的生物传感器成功地在真实人体唾液样本中定量了可替宁浓度。微流控技术的发展也很有用。通过将它与其他技术如ELISA,和干扰素释放试验集成在一起。在一项研究中,微流体分析与镀金电极组装在一个印刷电路板传感系统集成,整个微流控系统与电化学电极系统相连,用于细胞因子浓度的检测和验证,所研制的传感装置制作简单、快速、灵敏、准确。基于DNA的生物传感器具有高度的特异性,被广泛用于包括单分子在内的各种生物标志物的检测。利用高分辨原子力显微镜(AFM)在电化学基DNA生物传感器表面绘制紧密间隔探针和离散杂合事件,空间统计方法也被用于表征单分子水平的空间格局。研究表明,探针的接近可以增加它们与目标分子的杂合能力。对探针和目标分子构象变化的空间认识对提高生物传感器的灵敏度和重现性具有重要意义。它允许microRNA-21与H2杂交形成双链DNA,制备的组装物具有良好的催化活性和较高的导电性,对于microRNA的检测限为0.33fM,线性范围为1fM~1nM,所研制的电化学生物传感器也可用于其他生物标志物的检测。基于金纳米粒子以及钴卟啉ssDNA偶联物,我们开发了一种用于检测单个DNA分子的电化学DNA传感器或基因传感器。由于氧化还原标记的密度增加,以纳米粒子为基础的修饰在原子水平上提高了灵敏度,单分子检测方法可对23种DNA分子进行超灵敏检测。核酸适配体因其高亲和力、特异性和稳定性而成为众多单分子检测的极具潜力的候选者。利用石墨烯分子-石墨烯单分子结制备了用于可卡因单分子检测的一个基于纳米电路核酸适配体生物传感器。在本研究中,可卡因与适配体的相互作用在可卡因处理前后,均得到了明显的电流振荡,核酸适配体与可卡因结合后构象发生变化,揭示了其动态机制,其检测限计算为1nmoL-1。另一项研究描述了基于单分子光漂白的适配体传感平台,在这个平台系统中,两个探针(i)1链霉亲和素和4异硫氰酸荧光素标记生物素化RNA片段,生物素化RNA片段由2个重复的适配体片段组成(ii)采用Cy5染料标记适配体互补片段。在茶碱的作用下,触发了第一个探针与第二个探针的8个位点的结合,在这个基于适配体的传感系统中,红色荧光定量光漂白步骤,绿色荧光作为计数参考来提高整个传感系统的效率,观察到红色荧光和绿色荧光的共同定位,计算检测限为0.092nM。
针对分子的物理和化学性质的详细研究,单分子检测非常推荐,这对于检查其基本机制和性质必不可少。近年来,研究人员应用了多种技术来检测单分子,为此,我们总结了不同用于单分子检测的分析技术,从传统的技术到最近发展的生物传感技术。近年来,荧光检测越来越受欢迎,并且在等离子体共振、全内反射荧光、多光子激发荧光显微镜和近年来发展起来的生物传感技术等改进形式中仍然受到关注。在这些技术中,生物传感器对单个分子表现出优越的敏感性和选择性,为提高检测灵敏度,SERS、等离子体纳米孔和荧光等新兴技术得到了更进一步的开发。总之,未来需要像生物传感器这样的高灵敏度的单分子检测方法,有利于药物的发现和疾病的早期诊断。
声明:本平台注明来源的稿件均为转载,仅用于分享,不代表平台立场,如涉及版权等问题,请尽快联系我们,我们第一时间更正,谢谢!










