慢病毒载体(LV)是目前产业应用最成熟的病毒载体类型,尤其是在免疫细胞治疗,如CAR-T疗法中起到了关键性的作用。但是生产放大有一定的困难点。
慢病毒本质上是逆转录病毒中的一类,由于一般潜伏期较长,因此得名慢病毒。与其他的逆转录病毒类型相比,慢病毒能够能够穿透核膜,感染的更广泛的细胞阶段,对分裂细胞和非分裂细胞都能实现高效的感染。而大多数的逆转录病毒就没有穿透核膜的能力,只能等待有丝分裂时进入核中。因此在发展中慢病毒载体逐渐取代了原本的逆转录病毒载体体系。
目前常用的慢病毒体系仍然通过逆转录过程将目的片段整合到被感染细胞的基因组中。在病毒生产的过程中,表达外壳的质粒和搭载有目的片段的表达质粒被完全分割开,包装出的病毒不带有病毒外壳的基因序列,失去了复制的能力。因此常用的三质粒体系就已经有非常高的安全性,而后续进一步优化的四质粒体系则更加安全。
整体上来说,慢病毒感染体系完整保留了原本逆转录病毒高表达效率和长表达时间的优点,并且在感染能力上有了巨大的提升。目前的CAR-T产品就使用了以慢病毒为主的感染体系来实现T细胞中CAR的表达。从目前为止的表现上看,CAR-T发生的部分安全性问题都与慢病毒的使用无关。
LV与γ-逆转录病毒同属逆转录病毒科,都是将其双链DNA整合进宿主基因组,然后利用宿主的机制将其基因转录回RNA。一旦完成复制并回到胞浆,病毒RNA被翻译并被包装进一个新的病毒颗粒中,然后以出芽方式离开细胞完成生命周期。
LV拥有比γ-逆转录病毒更为复杂的基因组,存活和功能所需的基本基因是gag、pol和env基因,其中gag编码结构蛋白,pol编码逆转录所需的酶并整合到宿主细胞基因组中,env编码病毒包膜糖蛋白。
图1野生型HIV-1的基因结构
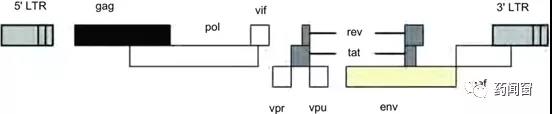
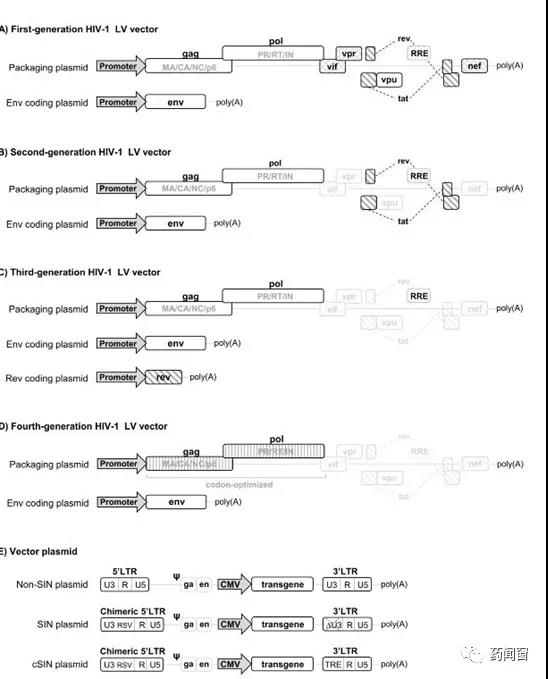
第一代LV载体含有大部分HIV基因组,包括gag、pol和env(最常见的是VSV-G)基因。其中,env基因在与其他慢病毒基因分开的质粒上编码。此外,辅助基因vif、vpr、vpu和nef以及调节基因tat和rev,都包含在第一代LV载体中。Vif、vpr、vpu和nef为体内慢病毒复制提供了存活/适应性优势,但它们对于体外病毒的生长不是必需的;病毒复制需要tat和rev;
第二代LV载体除去辅助毒力因子vif、vpr、vpu和nef,这不会影响遗传物质向宿主细胞的转移;
第三代LV载体的gag和pol基因在与rev或env基因不同的质粒上编码,将病毒基因组分成单独的质粒,并且在病毒基因组的3'LTR引入缺失以产生自失活(SIN)慢病毒载体,破坏LTR的启动子/增强子活性。这种由三个独立质粒制成的载体,既包含用于包装的必需病毒序列,又进一步提高了安全性。另外,第三代慢病毒载体还除去了不必要的tat基因,并将组成型活性启动子工程化到转基因构建体的上游LTR中。
研究者还设计了一个独立于Rev的第四代系统,以减少gag-pro-pol和转基因质粒之间剩余的残留序列同源性(图1D)。通过密码子优化,对Rev蛋白的需求也被取消了。另一种方法是消除导致病毒转录物不稳定和mRNAs降解的抑制性序列(INS)。尽管如此,由于这些方法的滴度低,第三代系统仍然是使用最多的。
图2 慢病毒包装系统的演变过程
难点一:慢病毒的生产依靠质粒瞬转,不具有复制性,因此其放大生产较难,包装系统细胞系的培养决定了其生产效率。
细胞培养可选用2D贴壁培养、3D贴壁培养、悬浮细胞培养的方式。其中2D培养易实现,但受人员、场地、设备的限制;3D培养细胞密度高,但高效转染存在挑战;悬浮培养易扩大,且可以使用无血清培养基,减少最终产品的潜在免疫原性物质污染,适合进行包装细胞的放大培养,但所用细胞需驯化,对工艺建立的挑战相对较大。
图3 质粒准备与慢病毒组装工艺流程
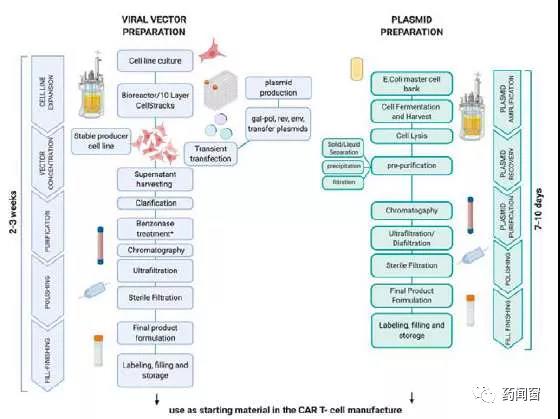
常用的慢病毒生产细胞为HEK293T,这类细胞可以在没有贴壁的情况下迅速悬浮生长。当前已商业化的适应大规模慢病毒GMP生产的细胞系以HEK293T细胞系为主。
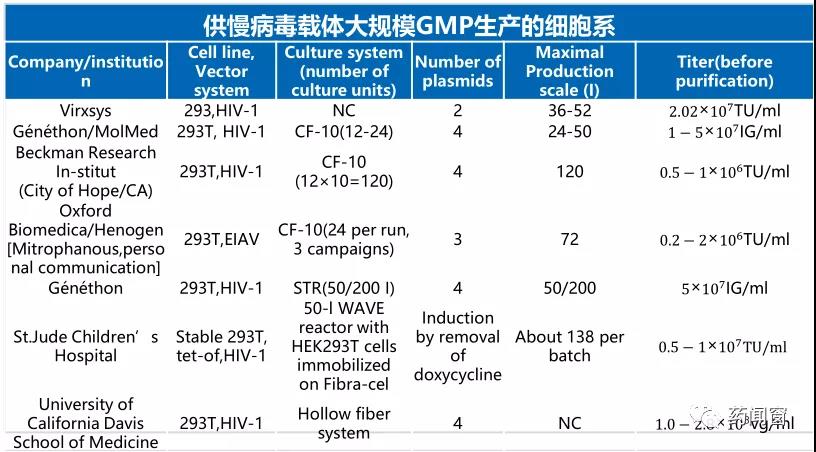
除了细胞系,慢病毒的悬浮无血清培养已逐步替代传统的贴壁培养模式,慢病毒贴壁培养的制备需要使用大量进口血清,而这些进口血清价格高昂,是成本中不可忽略的因素,慢病毒悬浮无血清培养可以极大地降低生产成本。另外,贴壁培养中,Cell stack替代细胞工厂也是一个趋势。最重要的是,慢病毒的生产主要依靠多层培养系统CF-10等(CF, Cell Factories),在该系统中慢病毒发酵收获通过简单的培养基置换即可完成。临床前与临床级的大规模生产通常收获1-3次。
难点二:GMP工艺放大的困难,主要考察指标包括纯度、滴度、及其他安全性指标。
纯度:由于慢病毒生产需要3或4质粒瞬转,其工艺控制较难,生产过程易遭受未成功组装病毒的污染,而下游的纯化富集同样会对慢病毒产品造成污染。慢病毒的质量控制包括对BSA(牛血清蛋白)、HCP(宿主蛋白)、HCD(宿主DNA)、核酸酶、胰蛋白酶、质粒等残留的检测。
慢病毒载体由于具有包膜结构,理化性质不稳定,对剪切力敏感,因此下游工艺中的回收率较低,通常只有10%左右,优化后的回收率大概为30-40%,滴度大约为10 6 -10 8 TU/mL,因此对下游纯化工艺的开发和优化是慢病毒规模化生产的瓶颈和关键。
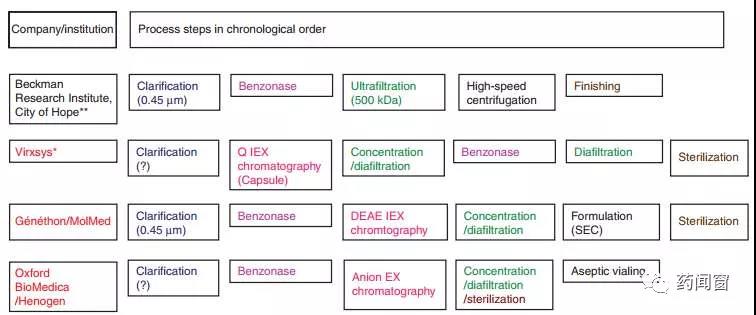
图4 不同公司/机构慢病毒大规模生产选用的下游工艺不同
工艺放大:常用的慢病毒生产细胞为293T细胞系,这类细胞可以在没有贴壁载体的情况下迅速悬浮生长,适应商业化的大规模慢病毒GMP生产。但稳定的悬浮细胞的培养需要对细胞系进行驯化,需注意多次传代后的细胞株稳定性,并需要利用3D悬浮培养系统等设备完成生产。
其他安全性指标:除检测RCL外,慢病毒还需通过支原体、内毒素、无菌检查等放行检测。
难点三:对生产厂房及设备的要求较高。
主流为P2生物安全防护的实验室及符合GMP规范的厂房;
利用隔离、单向流的设计防止交叉污染。
而在工艺方面,要求:1)全封闭工艺;2)一次性耗材;3)产量灵活满足商业化需求。
总的来说,慢病毒载体由于理化性质不稳定,回收率低,对下游纯化工艺的开发和优化是慢病毒规模化生产的瓶颈和关键。此外,慢病毒载体生产成本主要来自上游一次性耗材和质粒转染体系,发展规模化生产、开发不依赖转染系统的稳定细胞培养体系是降低成本的关键所在。
来源:药闻窗
声明:本平台注明来源的稿件均为转载,仅用于分享,不代表平台立场,如涉及版权等问题,请尽快联系我们,我们第一时间更正,谢谢!






