治疗性抗体已经在多个领域获得成功,如自身免疫疾病,肿瘤治疗,抗病毒等。传统的抗体为Y型结构,包含两个用于结合抗原的Fab和一个发挥效应的Fc,其中Fab的主要功能是特异性结合抗原,而Fc主要是和相关受体结合执行相应的效应功能。本文章我们将全面了解一下目前为止的Fc工程化改造,这些改造使得抗体满足相关机制要求,以更好的发挥治疗效果。
Fc与FcγR结合以发挥相应的细胞效应功能
人类含有6种不同的FcγR: hFcγRI,hFcγRIIA,hFcγRIIB, hFcγRIIC,hFcγRIIIA 和 hFcγRIIIB,这些受体与Fc有不同的亲和力。其中hFcγRI细胞外结构域含有三个免疫球蛋白结构域并且其与Fc的结合力最强,而其它受体细胞外区域仅含有两个免疫球蛋白结构域,它们与Fc的亲和力从较低到中等。
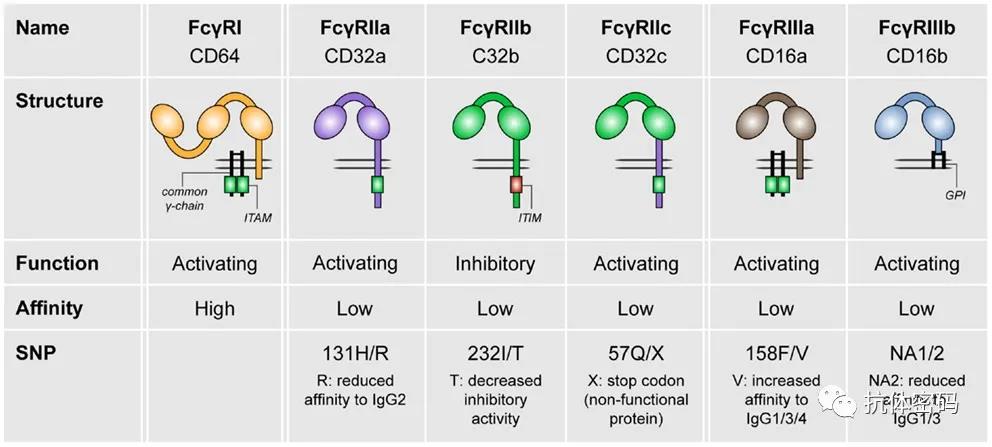
从功能上来看FcγR可以分为两大类,具有激活效应的受体和具有抑制效应的受体。其中hFcγRI,hFcγRIIA, hFcγRIIC,hFcγRIIIA。含有或与免疫酪氨酸激活图案(ITAM)相关。
含有ITAM(免疫酪氨酸激活基序)或与ITAM有关。其中人类激活受体中的两个hFcRγIIA和hFcRIIC)ITAM包含在FcγR本身的胞质内结构域中,而在其余的激活性受体中,它包含在相关的FcγR 链中。在小鼠中,含有4个FcγR,所有3个活化型的FcγR都需要FcγR 链来表达和传递信号。相比之下,FcγRIIB包含一个ITIM(免疫酪氨酸抑制性基序),是人类和小鼠中唯一的抑制性Fcγ R。除了这些激活性和抑制性FcγR之外,还有一个与GPI相连的hFcγR,它缺乏ITAM和ITIM基序,即hFcγRIIIB。它的功能不太清楚,有不同的研究显示其具有中性或诱饵受体的作用,调节FcγRIIA介导的中性粒细胞脱颗粒现象和ROS的产生。FcγRI是IgG的高亲和力受体,因此在很大程度上被循环中的IgG全部结合。尽管有证据表明它能够在某些B16小鼠模型中介导抗肿瘤免疫治疗,但它仍然被认为在免疫治疗中的具有较小的作用。因此,改变FcRI亲和力的相关研究相对较少。一般认为,当激活性和抑制性FcγR存在于一个特定的细胞类型上(在骨髓细胞上很常见),那么IgG与每个表达的FcγR的相对结合来调节细胞的反应。在实践中,激活性(A)与抑制性(I)或A:I 与FcγR的结合比率和/或FcγR的细胞表达谱是后续细胞活性预判的一个较好的指标,高的A:I比值提供了强有力的反应。其中另外一个关键的决定因素是抗体的亚型,例如hIgG1与大多数FcγR的结合,而hIgG4则要少得多。
hFcγR的遗传变异也可以影响表达和功能,特别是,某些单核苷酸多态性(SNPs)影响与IgG的结合。值得注意的是,158位的缬氨酸(V)到苯丙氨酸(F)突变影响FcγRIIIA与IgG1、IgG2的结合,以及在较小程度上与IgG3的结合,V158与F158相比,对hIgG1的结合力增加,从而导致激活效应的增加。同样地。Fc RIIA中第131位的组氨酸(H)到精氨酸(R)的突变会影响到与hIgG2的结合(在较小程度上影响到hIgG1),与R131相比,H131的结合增加。FcγRs可以影响抗肿瘤抗体的有效性,特别是通过激活Fc效应功能(如抗体依赖性细胞毒性(ADCC)和抗体依赖性细胞吞噬(ADCP))的抗体。ADCC被认为主要是由NK细胞发挥的效应功能。IgG与FcγRIIIA可以激活NK细胞并刺激释放含有穿孔蛋白和颗粒酶等分子的裂解颗粒,最终导致目标靶标细胞的裂解。许多临床上相关的抗癌抗体,如利妥昔单抗、赫赛汀和西妥昔单抗已被证明可以在体外激起NK细胞介导的ADCC。
ADCP是由吞噬细胞,如巨噬细胞、单核细胞和中性粒细胞介导的,该效应是由抗体与相应的激活性FcγRs相互作用诱发的。SGN-30是一种抗CD30抗体,用于治疗一些血液病,如霍奇金病,其可以在体外刺激ADCP。Rituximab和其他抗CD20抗体也被认为在体外和体内的各种动物模型中都能引起有效的ADCP效应。在这些模型中,去除巨噬细胞可以消除这些抗体的所有清除肿瘤细胞的能力,这突出了Fc介导的相关效应的重要性。
C1q参与并诱导补体介导的效应
由Fc介导的另一个重要的相互作用是它与补体的第一个成分C1q的结合。一旦有足够的Fc分子与C1q的6个球状头结合,它就会启动血清中补体蛋白的蛋白分解级联,导致过敏毒素的释放,如C3a和C5a,并在目标细胞表面形成膜攻击复合物,产生补体依赖性细胞毒性(CDC)。最初,有证据表明CDC在抗癌单抗 效应功能的发挥方面具有重要作用,通过体外研究证明的发现,肿瘤细胞过度表达补体防御分子,如CD55和CD59;而阻断这些分子可以增强利妥昔单抗的肿瘤杀伤力。CDC在抗癌抗体疗效中起作用的进一步证据包括:当慢性淋巴细胞白血病(CLL)细胞被利妥昔单抗处理时,补体成分的消耗增加;以及补体耗尽的CLL患者的血清对肿瘤肿瘤细胞裂解能力的降低。利妥昔单抗也被证明在C1q缺失的情况下是无效的。在人类淋巴瘤细胞的异种移植实验中,利妥昔单抗对C1q缺陷的小鼠也无作用,这表明补体激活是体内删除肿瘤活性的必要条件。然而,异种移植模型可能无法预测患者的补体活性,因为靶细胞可能对异种补体过于敏感。而用转基因小鼠模型(如hCD20转基因小鼠)的实验表明,没有补体激活功能的抗CD20抗体具有与野生型(WT)抗CD20抗体相当的B细胞清除能力。这表明,至少在小鼠中,补体活性是不必须的。同样的,C1q或C3的遗传性缺失并不明显影响用各种抗CD20 mAb对hCD20转基因小鼠B细胞的清除。临床数据表明,肿瘤细胞补体防御分子的表达无法预测滤泡性淋巴瘤(FL)患者接受利妥昔单抗治疗后的临床结果,进一步表明CDC不是决定利妥昔单抗成功清除肿瘤的关键因素。
Fc与FcRn相互作用延长抗体半衰期
由Fc介导的第三种主要的相互作用是与FcRn的作用。这种受体与FcγR家族在结构和功能方面都有很大不同。在结构上,该受体更接近于主要组织相容性复合体(MHC),但是它不包含信号转导的结构域。最初FcRn被认为在IgG从母体到胎盘的运输中起非常重要,但随后研究表明它在维持IgG平衡方面具有更广泛的作用。与上面概述的直接效应功能不同,这种相互作用使得抗体具有较长的半衰期,人类IgG抗体的半衰期超过20天,小鼠的半衰期为9天。血清蛋白,包括IgG不断地被单核细胞和内皮细胞内吞,FcRn能够使得被内化的IgG返回循环细胞表面并重新进入血液循环。这个过程中,FcRn以一种依赖于pH值的方式结合Fc的CH2-CH3界面。IgG的CH2-CH3结构域中保守的组氨酸残基(H310和H435)在酸性pH值(<pH6.5)下质子化,这使得FcRn和IgG之间能够紧密结合;一旦FcRn:IgG复合物循环到细胞外环境,中性pH值允许IgG重新释放到血液中,从而使得抗体得到保护不被清除。这一过程的重要性在FcRn缺失的小鼠身上得到了验证,其mIgG半衰期从9天缩短到1.4天,缩短了6倍以上。
一、Fc工程化改造增强ADCC或者CDC效应
过去的二三十年里,已经有多种技术用来确定Fc与结合的氨基酸(下图A)。在2001年的一项开创性研究中,Shields等人利用丙氨酸扫描诱变技术来确定hIgG1中结合hFcγR和hFcRn的氨基酸残基(图1A)。研究结果表明hFc与FcγR结合的位点hIgG1的铰链区下游和靠近CH2的区域(下图B)。参与这些相互作用的关键氨基酸残基随后成为突变研究的重点,并为后续hFc与FcγR相互作用的研究铺平了道路。
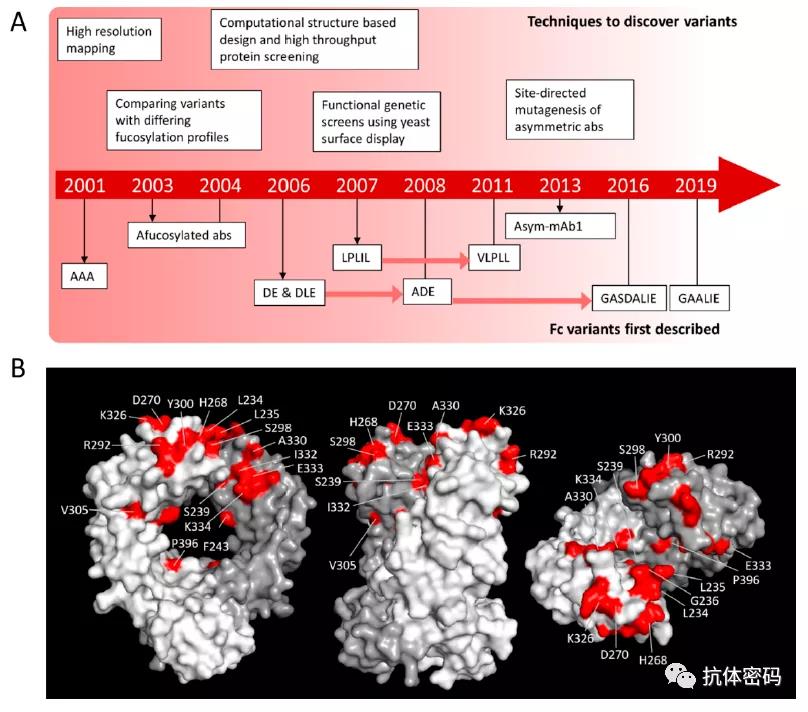
1.1 氨基酸突变增强相关效应
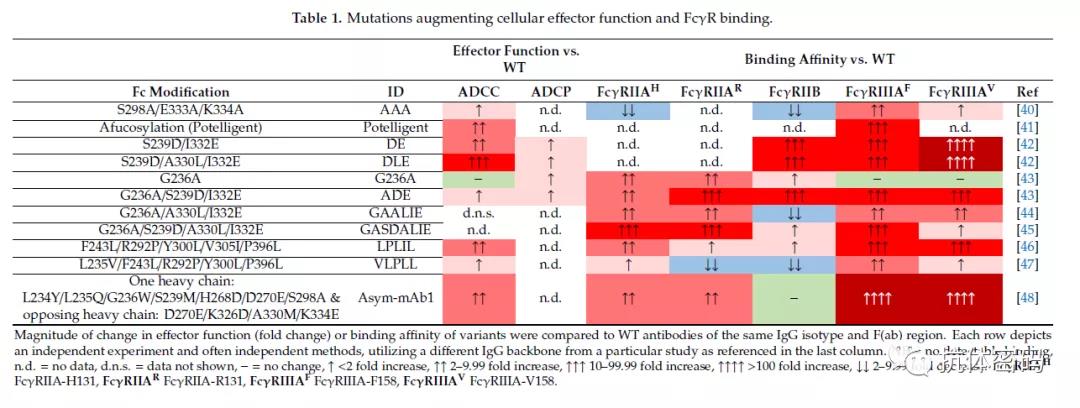
基于Shields等人的研究,多个研究团队通过在Fc的相关区域引入氨基酸突变氨基酸以增加A:I的比值,从而增强ADCC和ADCP等效应,上图A为相关技术的发展历程。基于他们最初的研究,Shields等人设计了包含S298A/E333A/K334A氨基酸突变,在IgG和IgE中,这些突变显示增强了Fc与FcγRIIIA的结合力,但对FcγRIIB结合力减弱。
一些团队还采用了基于结构的计算模型并结合高通量的筛选,以确定能够增强hFcγR介导的效应的氨基酸突变。例如,抗CD52的hIgG1抗体Alemtuzumab,当其进行S239D/I332E 或S239D/A330L/I332E突变时,发现其与FcγRIIIA和 FcγRIIB的结合亲和力都有所提高。研究发现这两种突变很大程度的提高了ADCC效应,而且ADCP效应也有微弱的提升;而对于CDC效应,S239D/I332E突变依然保持有CDC效应,S239D/A330L/I332E突变与野生型相比CDC效应有所减弱。
使用类似是研究方法,研究发现一些其它位点的突变可以显著的增加Fc对FcRIIA的结合力,从而增强ADCP效应。如引入G236A突变,在不增强对FcγRIIB 或者FcγRIIIA亲和力的前提下,可以显著增加Fc对FcγRIIA的亲和力(增加6-7倍)。在一个EpCAM抗体中,G236A使得抗体在保持ADCC效应的情况下增强了ADCP效应。但是,研究同时发现,G236A突变可以降低Fc与FcRI的亲和力(约7倍),因此一些其它的氨基酸突变用于解决该问题,如G236A/S239D/I332E突变,这三个氨基酸联合突变可以使Fc与所有FcγRs的亲和力增加约30倍,但是其增加ADCC和ADCP的能力却有限。
G236A/A330L/I332E 或者G236A/S239D/A330L/I332E突变是另外一种增强ADCC效应的氨基酸突变,两种突变都可以显著的增强Fc与FcγRIIA 和FcγRIIIA的亲和力,而G236A/A330L/I332E与G236A/S239D/A330L/I332E相比,前者对抑制性受体FcγRIIB的结合力也相对较弱。体内研究表明,带有G236A/A330L/I332E突变的CD20抗体显著的增强对CD20+B细胞的清除能力。但是在稳定性方面,该突变与野生型抗体相比具有较低的溶解温度((~55℃vs ~68 ℃),并且其半衰期也相对较短,这可能是因为G236A/A330L/I332E突变导致抗体稳定性降低。
F243L/R292P/Y300L/V305I/P396L突变是一种通过酵母展示技术筛选获得的新型的氨基酸突变,其在增强Fc对FcγRIIIA亲和力的同时降低了对FcγRIIB的结合力,以此来增加A:I的比值,进而到达增强Fc效应功能的目的。
下表是对目前的一些氨基酸突变增强Fc效应功能的汇总。
1.2 糖基化工程增强Fc效应功能
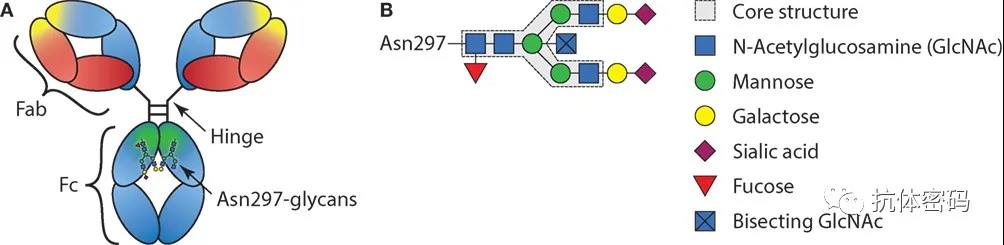
抗体重链的N297的糖基化在Fc效应功能方面也具有重要的作用,研究表明,N297的糖基化可以影响FcR和C1q对Fc的结合,从而影响相关的细胞效应。在IgG型的抗体中,N297的糖基化核心主要是由N- GlcNAc和其它糖共同组成,其中岩藻糖化的GlcNAc最常见,而岩藻糖的存在会通过空间位阻阻碍Fc的氨基酸与受体FcγRIIIA的结合,从而减弱ADCC效应,因此,去除岩藻糖可以增强FcγRIIIA与Fc的结合并增强ADCC效应。
1999有学者研究发现,当用过表达GnTIII酶CHO细胞表达IgG抗体时,抗体的岩藻糖化水平降低,因此ADCC效应得到增强。后续瑞士的生物公司Glycart以此方法开发了GlycoMab®平台,之后该平台被罗氏获得。
另外一种通过工程化降低抗体岩藻糖水平的方法是利用基因工程的手段敲除宿主细胞的FUT8基因。在哺乳动物细胞内岩藻糖与抗体Fc端上的氨基葡萄糖通过一个α-1,6糖苷键结合,这个糖苷键由FUT8基因编码的α-1,6-岩藻糖基转移酶催化形成。敲除FUT8基因将完全消除抗体Fc端的岩藻糖,从而提高单抗药物的ADCC作用。Kyowa Hakko Kirin Co公司的POTELLIGENT®技术平台就是通过敲除FUT8基因构建的ADCC增强型宿主细胞平台。
目前处于临床后期或者已经获批上市的用氨基酸突变或者去除岩藻糖以增强抗体ADCC效应的抗体如下表所示(红色标记的抗体药物)
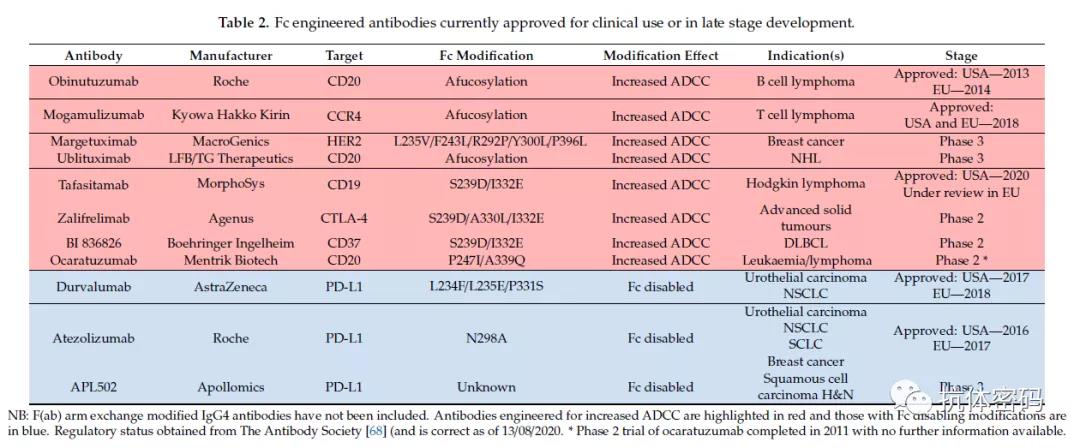
二、Fc工程化改造增强抗体的CDC效应
补体依赖的细胞毒性作用(complement dependentcytotoxicity, CDC)是补体通过特异性抗体与细胞膜表面相应抗原结合,激活补体经典途径,形成的攻膜复合物裂解靶细胞的作用。众所周知,CDC效应在机体抗击病毒或者微生物感染中起关键作用,然而越来越对的证据表明,在基于抗体治疗肿瘤的过程中,抗体介导的CDC效应也发挥了关键作用。Rituximab 和 ofatumumab是两款批准上市,靶向CD20的单克隆抗体,研究表明两个抗体在清除恶性B细胞的过程中都发挥了CDC效应。因此,增强抗体的CDC效应也许可以增强抗体的治疗效果。
下图为目前已知的Fc上影响CDC效应的氨基酸,而且目前的氨基酸突变也主要集中在这些氨基酸上。包括WS突变,RGY突变及EFTAE突变。
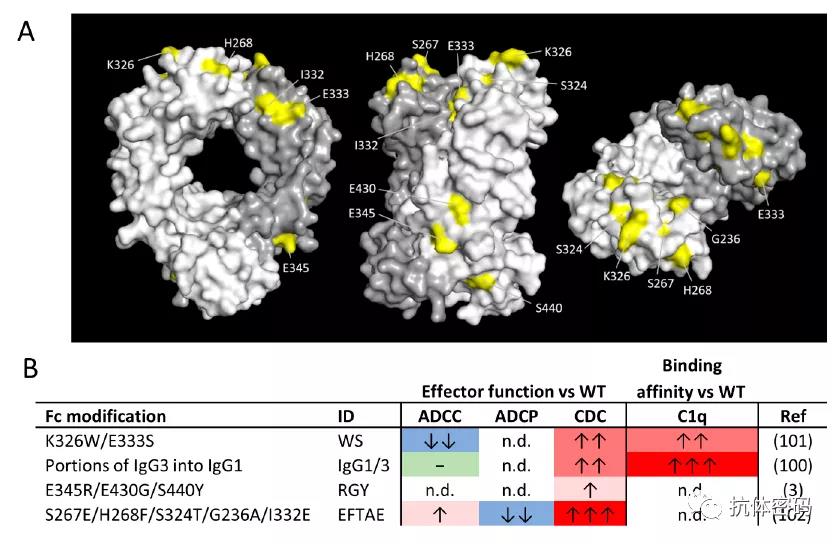
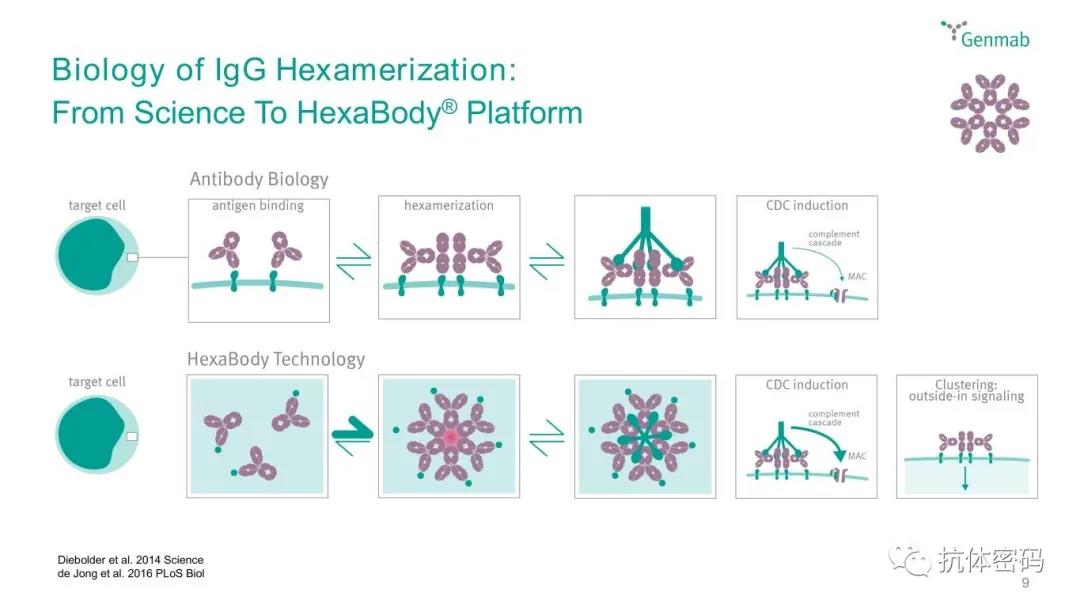
其中RGY突变为Genmab的HexaBody平台,该平台在E345R/E430G/S440T突变,可以增强抗体Fc与临近抗体Fc的相互作用,从而使得抗体形成6具体并于C1q结合,引发CDC效应。
三、工程化改造增强Fc与FcγRIIB的结合
FcγRIIB是小鼠和人类FcγR中唯一的一个抑制性受体,有研究表明,对于直接靶向肿瘤抗原清除肿瘤的抗体FcγRIIB的表达会抑制抗体对肿瘤的清除能力,这主要是Fc与FcγRIIB的结合在一定程度上抑制ADCP作用的发挥。相反的是,一些研究表明FcγRIIB可以通过有效的聚集效应正向调节激动型免疫调节抗体,如有研究表明,靶向DR5的抗体需要FcγRIIB的交联作用发挥抑制肿瘤的效果,不过该作用目前多发现靶向TNFRSF家族的一些抗体,如靶向CD40, 4-1BB 和OX40。
下图为目前研究发现的一些对FcγRIIB结合比较重要的一些氨基酸及目前已经报道的通过Fc氨基酸突变增强与FcγRIIB相互作用的方法。
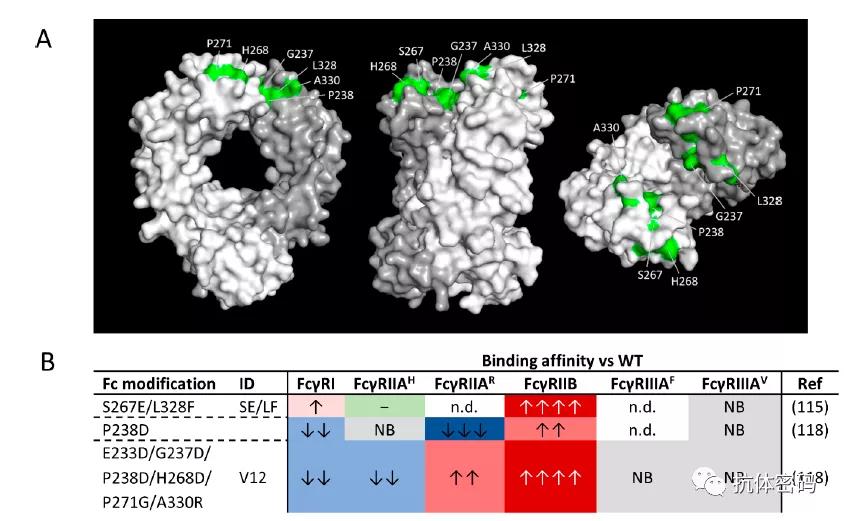
S267E/L328F组合突变是研究者利用计算机模拟并结合高通量筛选多达900个候选分子得到的,突变后Fc对FcγRIIB的亲和力增加了约430倍,但是其对Fc结合FcγRI和FcγRIIA-H131几乎没有影响(突变消除了Fc结合FcγRⅢA-V158的能力)。在一项体外研究中,靶向OX-40的抗体引入S267E/L328F突变可以增加抗体的激动能力,与野生型相比其激动能力增加两倍。
P238D和E233D/G237D/P238D/H268D/P271G/A330R突变是Mimoto等人通过对铰链区下游和CH2的30个氨基酸进行突变筛选的,其筛选超过500个不同的突变组合并发现P238D突变可以增强Fc与FcγRIIB的结合,但是其同时完全或者严重的消弱Fc与FcγRI, FcγRIIA-H131, FcγRIIIA-V131的结合。因此其研究团队在P238D的基础上引入其它突变进行研究,最终发现E233D/G237D/P238D/H268D/P271G/A330R突变可以大幅度增加Fc与FcγRIIB的结合(约270倍),并且几乎不影响Fc与FcγRIIIA的结合,一定程度上减弱对FcγRI 和FcγRIIA-H131的结合。
四、Fc工程化改造消除Fc相关效应功能
上面主要介绍的是通过工程化方法增强抗体Fc的相关效应,如ADCC和CDC等。但是,对于调节免疫细胞的靶点,如免疫检查点相关的一些抗体,过强的Fc效应反而会影响甚至消弱抗体的疗效。因此,在实际应用中需要通过各种方法减弱甚至消除Fc的相关效应。目前主要有三种方式减弱或者消除Fc的效应:1)氨基酸工程化改造Fc(与增强型改造相反,其主要减弱对相关受体的结合);2)糖基化改造;3)IgG4型抗体改造。
下图为一些主要技术发现的时间轴及Fc上一些可以消除Fc效应的关键位点。
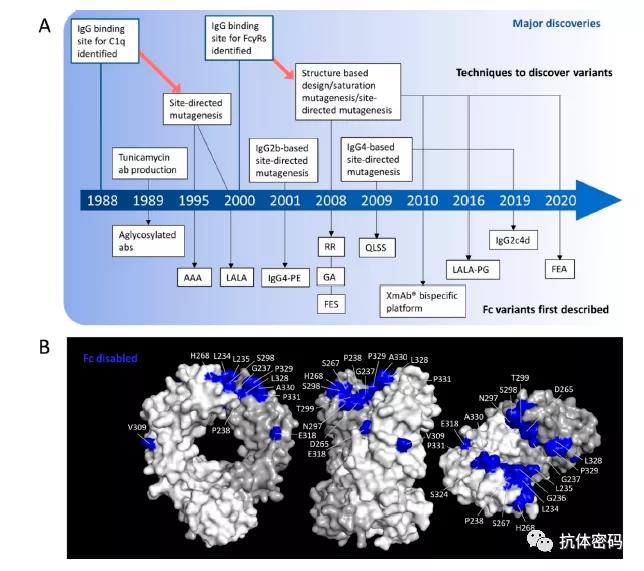
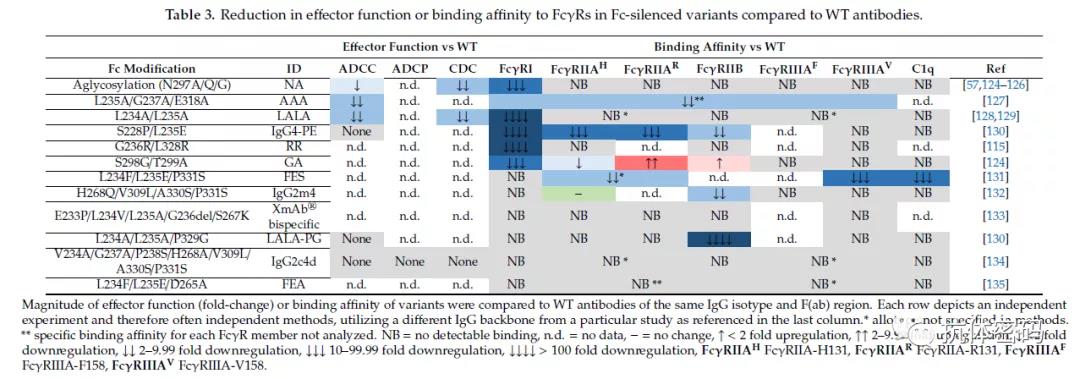
下表为目前通过氨基酸工程化改造消除Fc效应的技术汇总及对比
4.1 氨基酸突变降低效应功能
氨基酸突变降低效应功能与上面介绍的通过氨基酸突变增强Fc效应功能类似,也是主要通过计算机模拟,不同筛选方法筛选能够降低Fc与相关受体的结合而降低抗体介导相关的效应功能。目前主要的一些氨基酸突变包括L234A/L235A(IgG1), L234F/L235E/P331S(IgG1), G236R/L328R(IgG1), E233P/L234V/L235A/ G236删除(IgG1/ IgG2), L234A/L235A/P329G(IgG1)等,这里不再详述(见上表)。
4.2 糖基化改造降低效应功能
N297糖基化在稳定Fc构象方面具有重要作用,其使得Fc处于打开的状态,从而使得相关受体可以与Fc相互结合。因此N297糖基化的改变可以影响FcγRs与Fc的结合,研究表明,N297A, N297Q 和 N297G突变可以除去297位的糖基化,从而降低FcγRs和C1q对Fc的结合,最终导致ADCC,CDC等效应的降低。
4.3 hIgG4 Fc工程化改造降低Fc效应
在人类IgG的4个亚型中,IgG4是一个特殊的存在,其在血液中可以以半抗的形势存在,并且可以与其它IgG4抗体交换从而形成双抗。另外,其与FcRs 和C1q结合很弱,因此Fc相关效应功能很弱。在IgG4型抗体开发中,S228P突变可以有效的防止抗体以半抗形式存在,而且目前已经获批上市的抗体基本上都经过该位点的突变。
虽然IgG4仅有很低水平的Fc相关效应,为了进一步的降低该效应,研究者在S228P突变的基础上引入了L235E突变,S228P/L235E联合突变将ADCC效应降低到了不可检测的水平。除此之外,也有研究团队通过移植IgG4的氨基酸移植到其它亚型如IgG2用于降低Fc效应,H268Q/V309L/A330S/P331S或者V234A/G237A/P238S/H268A/V309L/A330S/P331S突变可以有效的降低IgG2的Fc效应。
五、Fc工程化改造延长抗体的半衰期
在肿瘤治疗中,抗体半衰期的延长可以降低病人给药的频率,而且较长的半衰期可以使得抗体持续的在体内发挥抗肿瘤作用。但是另外一方面,抗体持续的暴漏可能会导致相关副作用的产生,而且对于部分免疫调节型抗体,长的半衰期可能导致一些副作用无法控制,如细胞因子风暴等。因此,在药物开发中要充分考虑半衰期延长的危险与收益的平衡。
下图描述了半衰期延长相关技术的发展,Fc与FcRn结合的关键氨基酸,以及目前已经报道的延长半衰期的Fc的工程化改造技术
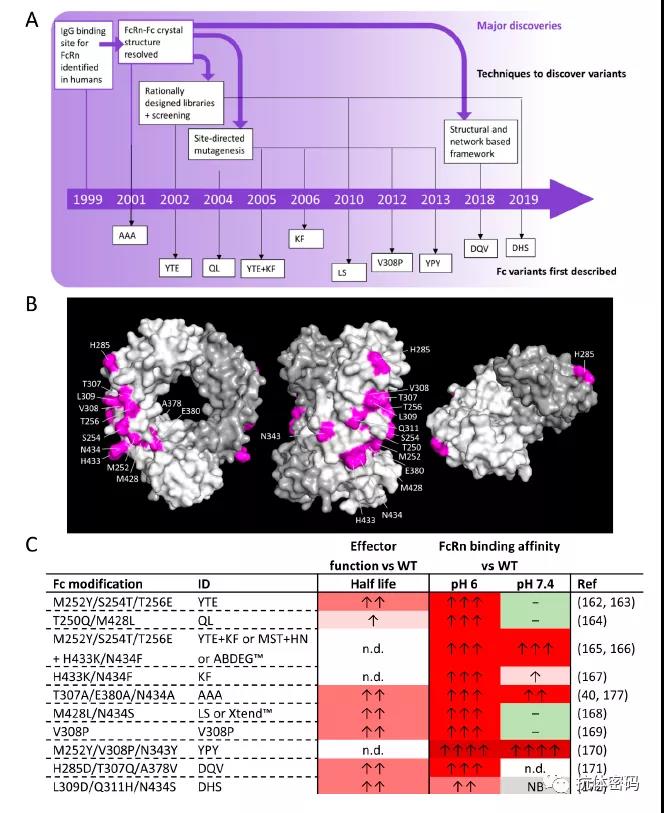
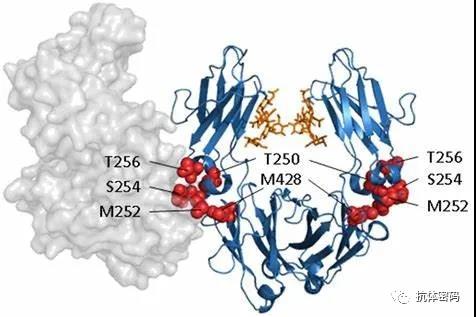
Fc与FcRn相互作用的氨基酸在1999年被鉴别,2年之后,研究者获得了Fc和FcRn的复合物结构,该结构表明H310 和 H435两个氨基酸对于Fc在不同条件下对FcRn的结合起关键作用。在同一年,研究者首次进行T307A/E380A/N434A突变延长抗体的半衰期。该突变使得Fc与FcRn在细胞内的结合提高了11.8倍,而在细胞外的PH下,两者的亲和力仅提高2.4倍。在小鼠体内的实验中,该突变将抗体的半衰期延长了2.5倍。
M252Y/S254T/T256E是Dall’Acqua等人利用噬菌体展示技术筛选的,该突变在细胞内酸性环境中使Fc与FcRn的结合能力提高了11倍,但是几乎没有影响两者在细胞外中性环境中的结合。在猴子体内实验中M252Y/S254T/T256E突变抗体的半衰期延长了4倍。但是,其在延长半衰期的同时也降低了ADCC效应,而且研究表明,该突变使得Fc的溶解温度降低了大约8℃,因此抗体在溶解性和聚集方面具有一定的风险。
一些其它的氨基酸突变,如M428L/N434S,T250Q/M428L,H433K/N434F等都是通过增强Fc与FcRn在细胞内酸性环境中的结合,而几乎不改变两者在细胞外的结合,从而达到增加半衰期的目的。
H285D/T307Q/A378V突变是减小Fc和FcRn结合的解离(koff_)而达到增加半衰期的目的,该突变同时可以增强Fc与FcγRs 和 C1q的相互作用,因此其同时具有增强ADCC和CDC的效应。
L309D/Q311H/N434S突变是在不影响胞内酸性环境下Fc与FcRn结合的前提下,使得Fc在胞外丧失对FcRn的结合,从而达到增加半衰期的目的。与M252Y/S254T/T256E突变不同,L309D/Q311H/N434S突变不会影响ADCC等效应。
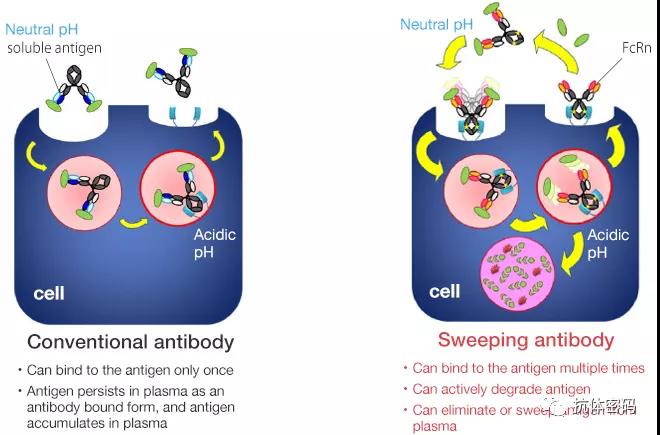
sweeping antibodies与上述突变不同,其主要是增强抗体在细胞外与FcRn的结合,突变后抗体在细胞内外和FcRn都有较高的亲和力。该抗体在细胞外无法被释放,因此其结合抗原后进入包内溶酶体,抗原被释放降解而抗体再次回到细胞膜,从而达到清除抗原的目的。
总结
Fc与相关受体的结合可以激发抗体的相关效应功能如ADCC,CDC,ADCP等,因此改变Fc与相关受体的结合能力可以增强或者减弱,甚至消除抗体的效应功能。目前,基于Fc与这些受体的结构,已经有多种技术如氨基酸突变和糖基化工程等已经用于改变抗体的效应功能。在临床中,这些效应功能的增强或是减弱主要与抗体的作用机制和作用靶点相关。
在众多医药公司中,中外制药无疑是Fc效应功能研究的佼佼者,其已经开发了多种与Fc效应功能相关的技术,如Recycling antibody,Sweeping antibody,TwoB-Ig,pI-FcTM,ART-Fc,ACT-Fc等;另外,Zymeworks也开发了相应的技术平台EFECTTM;Argenx也有相应的技术平台如NHANCE®, ABDEG™ 和 POTELLIGENT®(后续我们会详细介绍)。
参考文献
1.Rena Liu , Robert J. Oldham , Emma Teal et al. Fc-Engineering for Modulated Effector Functions—Improving Antibodies for Cancer Treatment.Antibodies 2020,
来源:抗体密码
声明:本平台注明来源的稿件均为转载,仅用于分享,不代表平台立场,如涉及版权等问题,请尽快联系我们,我们第一时间更正,谢谢!






