不光是Phadia试剂,其他任何一家过敏原检测试剂都会涉及两条标准曲线,一个是特异性IgE标准曲线,另一个是总IgE标准曲线。
很多人做过敏原研发的初期都会有一个疑问,特异性IgE曲线和总IgE曲线到底有什么区别?它们俩是不是同一个东西?我想告诉大家的是,因为特异性IgE目前没有标准品,所以只能用总IgE去给特异性的定值。所以不管是特异性的还是总的,它们都是一对鼠抗人IgE单抗,只不过很有可能用的不是同一个配对而已。为什么这么说呢?我们看一下两个曲线的实际测试数据:
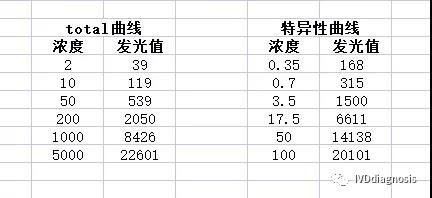
总IgE的线性范围是2-5000IU/mL,高低值的比值范围是2500倍;
特异性IgE的线性范围是0.35-100IU/mL,高低值的比值范围是285倍;
Phadia100仪器的荧光值的可报告范围大约是20-25000,对比两组数据我们就可以看到,不管是sIgE还是tIgE,他们在区间相差接近10倍的范围内,发光值均遍布在20-25000;并且拿100IU/mL的发光值来看,tIgE的发光值约在1000附近,sIgE的已经到了20000,并且我们知道tIgE的酶浓度是2ug/mL,而sIgE的酶浓度是1ug/mL,tIgE酶浓度高发光值反而低了20倍,充分说明了两个配对大概率不是同一个。
tIgE为了照顾更宽的区间,所以它的配对对灵敏度要求不高;sIgE为了充分利用荧光仪器的可报告范围,所以灵敏度相对来说就要高出很多。
另外咱们来讲一下关于过敏原试剂定量的问题(大家可以思考一下以下2个问题):
1.很多人都知道,过敏原检测试剂的这个0.35IU/mL的cutoff值来自于Phaida CAP,但是你们有没有考虑过,他们最开始研发这个试剂的时候,这个值是怎么来的呢?2.另外就是,所有特异性IgE检测项目都是共用的同一条特异性曲线和同一个cutoff值,这么做真的合理吗?Phadia的研发真的有这么牛吗?比如现在我是全球第一家开发特异性过敏原IgE检测的厂家,我就随机确定了一个鼠抗人IgE抗体配对,保证总IgE测试的线性区间不低于3个数量级,(比如0.1-100IU/mL);我们现在最先研发的是黄花蒿、户尘螨、狗毛、猫毛这4个项目,每个项目均按照5ug/mL的蛋白包被量包被;另外对于每个项目,我们均选取200个临床症状为阴性和阳性的2组人进行测试,将测试结果绘制ROC曲线去确定最佳的cutoff值,有可能会是以下的结果: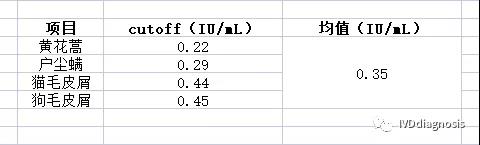
对于不同项目的不同的cutoff值,我们再通过包被量去微调至0.35。
所有的项目,都是用一个标准曲线,这是对变应原原料一个极大的考验。想让所有的原料都服从一个曲线,并且cutoff值和线性范围都能满足要求,真的是挺难的,我不知道phadia的研发人员这些年到底做了多大的努力,每个项目的临床相关性到底如何,反正他们的试剂性能从各个指标分析来看,确实是很优秀。
作为过敏原检测试剂的开拓者,我们可以对他们存疑,但phadia确实为我们提供了溯源的标准,他们最开始的研发者也为后来企业本身的原料质控和临床研究提供了大量的帮助。 来源:IVDdiagnosis
声明:本平台注明来源的稿件均为转载,仅用于分享,不代表平台立场,如涉及版权等问题,请尽快联系我们,我们第一时间更正,谢谢!




